
|
|
Ионизация железа в кислых средахМеханизм К.Хойслера (1958 г) Исследуя кинетику растворения железа в кислых хлоридных растворах с рН > 1, К.Хойслер получил следующие кинетические параметры: (дφ/дlgia )Сi =30 мВ; (дlgia /дlgCQH–)Сi,φ =1,55. Подобные кинетические параметры имели место при проведении стационарных измерений, нестационарные (быстрые) измерения привели к следующим результатам: bа=60 мВ, (dlgia/dlgC0H-) Сi,φ = 1. На основании полученных кинетических параметров, а величина bа также, безусловно, является кинетическим параметром, так как наклон, согласно рис. 11, влияет на характер зависимости ia = F(φ), автор предположил механизм ионизации железа, широко известный в научной литературе как механизм Хойслера. Схема процесса такова: Fe + OH– « (FеOH)адс+e; (34) FеOH)адс + Fe « Fe(FеOH)адс; (35) Fe(FеOH)адс + OH– ® (FеOH)адс + (FеOH+)адс + 2e; (36) (FеOH+)адс + Н+ « Fe2+ + H2O. (37) В схеме Хойслера частица (FеOH)адс выполняет роль катализатора. Она участвует в процессе, но сама в результате его не претерпевает качественных и количественных изменений. Поэтому механизм Хойслера часто называют каталитическим. Выведем это кинетическое уравнение для стационарных условий. В подобном случае для лимитирующей 2-х электронной стадии можно записать: i = k36 CFe(FеOH)адсCOH– е2bφF/RT Выразим C Fe(FеOH)адс через COH– . С этой целью используем квазиравновесие стадии (35). Так как этот процесс является химическим, с чем мы еще не встречались, хотя последовательное протекание химических и электрохимических стадий при ионизации металлов наблюдается довольно часто, то используем не уравнение Нернста, а выражение для константы равновесия. Kc = Величину C(FеOH)адс найдем из зависимости, действительной для стадии (34). Так как (34) - квазиравновесный процесс, то можно записать уравнение: φ = φ eφF/RT× e–φ°F/RT = C(FеOH)адс = k34 COH– еφF/RT тогда: CFe(FеOH)адс = k34 Kc COH– еφF/RT iа = k36 k34 Kc COH– COH– е2bφF/RT еφF/RT iа = k C2OH– е φF(2b+1) /RT bа = nOH- = 2, что авторы посчитали близким к экспериментально найденной величине 1,55. При нестационарных измерениях, по мнению Хойслера, изменение CFe(FеOH)адс не успевает за изменением потенциала электрода. Следовательно, поверхностную концентрацию этой промежуточной частицы, которая, кстати, является бидентатным комплексом, можно считать постоянной (k1).Тогда эта величина не зависит от COH–, то есть при выводе кинетического уравнения автор предлагает не учитывать стадии (34) и (35). Отсюда кинетическое уравнение процесса в целом тождественно кинетическому уравнению лимитирующей стадии: iа = k36 k’1 COH–е2bφF/RT Из него следует: nOH– = 1, bа =
Механизм Бокриса Бокрис с coтрудниками (Дражич, Деспич, 1961 г.) изучили скорость ионизации железа в сульфатных растворах с рН= 1,2...4,5. Они получили следующие кинетические параметры: nOH– = 1, Ва = 40 мВ и предложили записанный ниже механизм процесса: Fe + OH– « (FеOH)адс+e; (38) (FеOH)адс ® (FеOH+)адс + е; (40) (FеOH+)адс « Fe2+ + ОН–. (41) Не трудно получить соответствующее этому процессу кинетическое уравнение. Для второй лимитирующей стадии имеем: i40 = k40 CFeOH еbφF/RT Соответственно для первой квазиравновесной стадии запишем:
Откуда CFeOH = k COH– .еφF/RT Сочетая кинетические уравнения первой и второй стадий, получаем: iа = k COH– е φF(1+b) /RT где nOH– = 1 и bа = что удовлетворительно согласуется с экспериментальными данными. Работами В.Лоренца с сотрудниками было показано (1965 г.), что механизмы Хойслера и Бокриса могут реализоваться параллельно. Первый наиболее вероятен, то есть вносит наибольший вклад на поверхности, характеризующейся большим количеством активных центров, то есть очень неоднородной по реакционной способности. Наоборот, на поверхности, отожженной при высокой температуре (900°С, инертная атмосфера) и, следовательно, отличающейся малой концентрацией активных центров (концентраторов напряжений и т.д.), реализуется преимущественно механизм Бокриса. Таким образом, за период с 1947 по 1965 г. экспериментально было показано, что в процессах ионизации железа принимают участие гидроксид-ионы либо, точнее, молекулы растворителя. Кстати, стадию (38) механизма Бокриса целесообразнее записать именно с участием молекул воды, учитывая высокую гидрофильность железа. В этом случае протекает электрохимическая реакция Fe + H2O « FeOH + H+ + e, которая не приводит к изменению вида кинетического уравнения. Предлагаем читателю доказать это. Одновременно в работах академика Я.М.Колотыркина и его школы последовательно проводилась мысль, что в анодном растворении металлов принимают участие и анионы кислот. Хойслер и Бокрис этого не обнаружили по ряду причин: 1. Они работали в растворах со сравнительно высокими величинами рН, в которых ионы ОН– адсорбционно вытесняют с поверхности металла анионы кислот. 2. Они вообще не рассматривали действие анионов с использованием комплексных электролитов состава: Км НА + Хм МеА + (1 - Х)м МеВ, где В - поверхностно-малоактивный анион, А - анион, действие которого изучается. Я.М.Колотыркин, основываясь на результатах значительного количества экспериментальных данных, сделал вывод, что «специфическую адсорбцию анионов, начинающуюся при значительно более отрицательных потенциалах, чем потенциал растворения металла, следует рассматривать как начало образования (за счет связей, близких по природе к химическим) соответствующей соли». На первой стадии адсорбции прочность этой связи заметно отличается от прочности связи соответствующего индивидуального соединения. По мере сдвига потенциала металла в сторону положительных значений эта разница уменьшается, а ионы металла начинают переходить в раствор в виде комплексных соединений с адсорбированными анионами. Механизм процесса ионизации можно представить в виде двух последовательных стадий: Ме + kA– ® MeA MeA +, если n > k, и –, если n < k. Анион может оказывать двоякое действие (рис. 12). При малых концентрациях он в ряде случаев замедляет скорость анодной ионизации (участок 1 кривой рис. 12) за счет того, что адсорбционно вытесняет участвующие в процессе ионизации частицы, например, ОН–, RO–, где R - углеводородный радикал типа СН3, С2Н5 и т.д., сам же еще участвовать в реакции не может, так как адсорбируется на сравнительно малоактивных адсорбционных центрах. Таким образом, автоматически вводится и понятие энергетической неоднородности адсорбционных центров. При сравнительно больших концентрациях анион принимает непосредственное участие в ионизации металла (смена механизма, участок 2 кривой рис. 12). Такая картина наблюдалась при ионизации железа армко в этиленгликоле (В.И.Вигдорович, Л.Е.Цыганкова).
Рис 12. Зависимость скорости растворения железа в кислых этиленгликолевых растворах НС1 от концентрации аниона. Постоянные ионная сила раствора и потенциал электрода.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ; CFe(FеOH)адс = Kc C(FеOH)адс
; CFe(FеOH)адс = Kc C(FеOH)адс +
+ 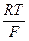 ln
ln  ;
; , при b = 0,5 bа = 30 мВ.
, при b = 0,5 bа = 30 мВ. =60 мВ
=60 мВ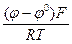 = ln
= ln  ;
; = 40 мВ,
= 40 мВ,
 + ne
+ ne