
|
|
Ионизация металла протекает через две последовательные одноэлектронные стадии. Компоненты раствора не участвуют в ионизацииЗапишем предполагаемые уравнения последовательных электрохимических реакций Ме ⇄ Ме+ + е (24) Ме+ ® Ме2+ + е. (25) Такой механизм может иметь место в том случае, если i0,1 >> i0,2. (i0,i - ток обмена соответствующей стадии). В этом случае первая стадия является быстрой по отношению ко второй и, благодаря наличию последующей медленной реакции, равновесной или точнее квазиравновесной, что находит отражение в записи уравнения реакции. Это значит, что в исследуемой области потенциалов вблизи поверхности электрода величина СМе+ является близкой к равновесной. Одновременно подобная запись уравнений (24) и (25) указывает, что продукты реакции и частицы рабочего раствора не адсорбируются на поверхности электрода и не принимают участия в реакции ионизации металла. Такие условия, в частности, реализуются при анодном растворении меди в кислых перхлоратных растворах, в которых и было показано наличие для нее такого механизма (В.В.Лосев, А.И.Молодов). Получим для этого механизма процесса кинетическое уравнение. С этой целью для второй лимитирующей скорость процесса стадии запишем кинетическое уравнение: i25 = k25 СМе+ е Концентрацию однозарядных ионов меди (СМе+), выступающих в роли промежуточного продукта и часто называемых низковалентными частицами (НВЧ), можно выразить из первого уравнения. Так как первая стадия (уравнение (24)) является электрохимической (наличие переноса заряда через границу раздела фаз) и квазиравновесной, то для нее справедливо уравнение Нернста (n = 1): φ При дальнейшем рассмотрении индексы при φ опущены. Решим уравнение в явном виде относительно СМе+:
Примем е Тогда получим СМе+ = k1 е Подставим последнее уравнение в кинетическое уравнение лимитирующей стадии: i25 = k25 k1 еφF/RT еbφF/RT; i25 = kеφF(1 + b)/RT = k ехр[(φF(1 + b)/RT]. Тафелевский наклон анодной поляризационной кривой в этом случае равен bа = (2,3RT)/(1 + b)F. Приняв β = 0,5, получим: bа = Легко видеть, что по сравнению с предыдущим случаем (bа = 0,060 В) меняется величина bа и эти случаи легко различимы. Если в подобном процессе лимитирует стадия (24), то кинетическое уравнение принимает вид iа = k еbφF/RT = k ехр(bφF/RT), что также легко дифференцируется (рис. 11), т.к. при b = 0,5 bа =
Рис. 11. Тафелевы участки анодных поляризационных кривых, характеризующиеся различными величинами тангенса угла наклона к оси абсцисс. bа, мВ: 1 – 40; 2 – 60; 3 – 120.
Если процесс ионизации металла протекает через три последовательные одноэлектронные стадии без участия частиц раствора и последняя стадия является лимитирующей, то механизм ионизации можно записать следующим образом: Ме « Ме+ + е; (27) Ме+ « Ме2+ + е; (28) Ме2+ « Ме3++ е. (29) Получим кинетическое уравнение этого процесса. Для лимитирующей стадии (29) имеем: i29 = k29 Cме2+ еbFφ/RT. Для второй квазиравновесной стадии действительно уравнение Нернста: φ откуда имеем: Cме2+ = k28 Cме+ еFφ/RT Найдем величину Cме+. Для этого используем квазиравновесие первой стадии. Для нее также справедливо уравнение Нернста: φ Откуда Подставим последнее выражение в концентрационную зависимость, полученную за счет квазиравновесия стадии (28): СМе2+ = k28 k27 еφF/RT еφF/RT = k’ е2φF/RT И, наконец, величину СМе2+ подставим в кинетическое уравнение лимитирующей стадии:
i29 = k29 k’Cме2+ е2φF/RTеbFφ/RT и окончательно
i = k exp[(2+β)φF/RT], a bа = где 2 - число предшествующих лимитирующей одноэлектронных квазиравновесных стадий. В общем случае для т предшествующих квазиравновесных стадий кинетическое уравнение имеет вид: i29 = k еφF(m+b)/RT Величина m+b называется кажущимся коэффициентом переноса, а тафелевский наклон при b = 0,5 определяется зависимостью: bа =
ЭКСПЕРИМЕНТАЛЬНО НАБЛЮДАЕМЫЕ МЕХАНИЗМЫ АНОДНОГО РАСТВОРЕНИЯ ЖЕЛЕЗА Щелочные растворы Кинетику анодного растворения железа вщелочных растворах впервые изучали А.Н.Фрумкин, Р.Х.Бурштейн, Д.Б.Лейкис и Б.Н.Кабанов (1947 г.). Они обнаружили участие в процессе ионизации анионов раствора (частиц ОН–). По их данным, анодная поляризация активного железа в подобных средах (активное анодное растворение) характеризуется тафелевским наклоном bа = 40 мВ, а порядок анодной реакции по гидроксид-ионам равен 3/2. Авторы этой работы были в числе немногих для своего времени, которые объяснили полученные кинетические параметры посредством стадийного механизма протекания процесса, согласно схеме: Fe + OH– « (FеOH)адс+e; (30) (FеOH)адс + OH– ® (FeO) адс + H2O + e; (31) (FeO) адс + OH– « НFeO2– (32) НFeO2– + H2O « Fe(OH)2+ OH– (33) Таким образом, в предложенном механизме процесса лимитирующей является вторая стадия. Следовательно, первая - быстрая, квазиравновесная, а (32) и (33) вообще не оказывают какого-либо влияния на кинетику процесса, являясь также квазиравновесными. Для предложенной схемы (30) - (33) авторы получили кинетическое уравнение: iа = k C2ОН_ ехр( согласно которому порядок по гидроксид-ионам равен 2. Экспериментально, как указано выше, в работе получена величина 3/2, что отмечалось как удовлетворительное совпадение. Тафелевский наклон, исходя из кинетического уравнения, равен: bа = что также хорошо совпадает с экспериментальными данными. Выведем кинетическое уравнение, соответствующее предложенному механизму (30) - (33). Скорость лимитирующей стадии равна: i31 = k’31 [(FeOH)адс] [OH–]ехр(bFφ/RT)
Величину [(FeOH)адс] найдем из уравнения Нернста для 1-й квазиравновесной стадии: φ= φ откуда [(FeOH)адс] = k30 [OH–]exp(φЕ)/RT). Подставим последнее уравнение в выражение зависимости тока от потенциала для лимитирующей стадии. i31 = k’31 k30 [OH–][OH–] ехр(bFφ/RT) ехр(Fφ/RT) i31 = k31 [OH–]2 ехр iа = k [OH–]2 е(3φF/2RT) Слабостью этого вывода является предположение авторов (по умолчанию), что степень заполнения поверхности адсорбированными частицами невелика, то есть в этом случае справедлива изотерма Генри. Вместе с тем, известно, что железо является металлом, характеризующимся энергетически равномерно-неоднородным типом поверхности и, если степень заполнения поверхности электрода адсорбированными частицами более 20 %, нужно учитывать снижение энергии адсорбции с заполнением, что сказывается на кинетике реакции. Если использовать изотерму Темкина (об этом ниже), то, видимо, можно получить лучшее совпадение теории и экспериментальных данных по (дlgia /дlgCQH–)Сi,φ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
. = φ
= φ  +
+ 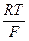 ln СМе+ (26)
ln СМе+ (26)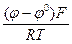 lnСМе+; СМе+ = е
lnСМе+; СМе+ = е  е
е 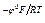 .
. = 0,040 В.
= 0,040 В. = 0,116 В
= 0,116 В
 +
+ 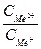 ;
; ×
× 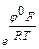 =
= 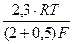 = 0,024 В
= 0,024 В =
= 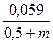 В
В φF/RT)
φF/RT) = 40 мВ,
= 40 мВ, ;
;