
|
|
НАХОЖДЕНИЕ В ПРИРОДЕ. ПОЛУЧЕНИЕ. СВЯЗЬ С ДРУГИМИ КЛАССАМИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙАЛКАНЫ ГОМОЛОГИЧЕСКИЙ РЯД. ФИЗИЧЕСКИЕ СВОЙСТВА 1. НАИБОЛЕЕ ПОЛНОЕ И ТОЧНОЕ ОПРЕДЕЛЕНИЕ АЛКАНОВ 1) насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой только s-связями 2) насыщенные углеводороды с открытой цепью атомов, связанные только s-связями 3) углеводороды, в которых все атомы углерода находятся в состоянии sp3-гибридизации 4) насыщенные углеводороды, в которых все атомы углерода находятся в состоянии sp3-гибридизации, связанные между собой и атомами водорода ковалентными s-связями
2. ОШИБОЧНОЕ НАЗВАНИЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ
3. ЛЕГЧЕ ДРУГИХ ПЕРЕВЕСТИ В ЖИДКОЕ СОСТОЯНИЕ
4. ОШИБКА В ХАРАКТЕРИСТИКЕ МЕТАНА
5. НЕВЕРНАЯ ХАРАКТЕРИСТИКА АЛКАНОВ 1) Полярность молекул алканов, которая вытекает из полярности С-Н связей, в сильной степени определяет (повышает) температуры плавления и кипения алканов 2) С2Н6 – температура кипения равна (-88,30С); С6Н14 – температура кипения равна (690С); С12Н26 – температура кипения равна (216,20С). Температура кипения во многом зависит от массы алкана. 3) Бутан – температура кипения – (-0,50С); изобутан – температура кипения (-10,20С). Разница температур кипения н-бутана и изобутана определяется разными расстояниями между молекулами в жидкой фазе (в изобутане они больше) 4) это углеводороды с малополярными молекулами 5) легко смешиваются (жидкие и твердые) с водой и другими полярными растворителями 6) жидкие алканы хорошие растворители для жиров и жирных масел 7) химически инертные вещества 8) характерны реакции замещения
6. НАИБОЛЕЕ ВЫСОКУЮ ТЕМПЕРАТУРУ КИПЕНИЯ ИМЕЕТ
7. ОШИБОЧНАЯ ХАРАКТЕРИСТИКА ФИЗИЧЕСКИХ СВОЙСТВ ГАЛОГЕНПРОИЗВОДНЫХ АЛКАНОВ 1) Это вещества нерастворимые в воде 2) Полифторпроизводные углеводородов химически инертны, нетоксичны, устойчивы 3) По мере увеличения числа атомов галогена в составе вещества (число атомов углерода постоянно) возрастают температуры плавления и кипения, плотности 4) йодпроизводные углеводородов – вещества плохо растворимые в бензоле.
8. В ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ НЕ ВХОДИТ ВЕЩЕСТВО, ФОРМУЛА КОТОРОГО
НОМЕНКЛАТУРА И ИЗОМЕРИЯ
9. АЛКАН СО СТРУКТУРНОЙ ФОРМУЛОЙ
1) 2,4-диметил-4-этилпентан 4) 3,3,5-триметилгексан 2) 2,4,4-триметилгексан 5) диметилэтилизобутилметан 3) 2,4 – диметил-4-этилпентан
10. ФОРМУЛА ДИМЕТИЛЭТИЛМЕТАНА
1) 2-метил-2-этилгексан 4) н-нонан 2) 3-метил-4,4-диэтилгексан 5) н-гептан 3) триметилизопропилметан
12. КОЛИЧЕСТВО ИЗОМЕРНЫХ ОДНОВАЛЕНТНЫХ РАДИКАЛОВ С ФОРМУЛОЙ С4Н9 РАВНО
13. НАЗВАНИЕ ВТОР-БУТИЛ ИМЕЕТ РАДИКАЛ
14. ДИБРОМПРОИЗВОДНЫЕ ПРОПАНА ИМЕЮТ ЧИСЛО ИЗОМЕРОВ (включая энантиомеры) 1) три 2) четыре 3) пять 4) шесть 5) больше шести
15. КОЛИЧЕСТВО ВЕЩЕСТВ, ИЗОБРАЖЕННЫХ СЛЕДУЮЩИМИ ХИМИЧЕСКИМИ ФОРМУЛАМИ 1) двум 2) трем 3) четырем 4) пять
16. ВЕЩЕСТВО, СТРУКТУРНАЯ ФОРМУЛА КОТОРОГО
1) 6-бутил-3,4-диметилоктан 4) 7,8-диметил-5-этилдекан 2) 3,4-диметил-6-этилдекан 3) 3-бутил-5,6-диметилоктан
17. СТРУКТУРА, ВКЛЮЧАЮЩАЯ ВТОР-БУТИЛЬНУЮ ГРУППУ 1)
18. ВЕЩЕСТВО, ИМЕЮЩЕЕ ФОРМУЛУ
1) 5-вторбутил-3-метил-4-этилдекан 3) 5-изобутил-3-метил-4-этилидекан 2) 6-вторбутил-8-метил-7-этилдекан 4) 3,6-диметил-5-пентил-4-этилоктан
19. ФОРМУЛА МОЛЕКУЛЫ, ИМЕЮЩЕЙ В СВОЕМ СОСТАВЕ НАИБОЛЬШЕЕ ЧИСЛО ТРЕТИЧНЫХ УГЛЕРОДНЫХ АТОМОВ 1)
УСТАНОВИТЕ СООТВЕТСТВИЕ 20. ФОРМУЛЫ И НАЗВАНИЯ АЛКАНА
21. СТРУКТУРНОЙ ФОРМУЛЫ И НАЗВАНИЯ ГАЛОГЕНАЛКАНА А)
СТРОЕНИЕ 22. МОЛЕКУЛА МЕТАНА ТЕТРАЭДРИЧЕСКАЯ ПОТОМУ, ЧТО 1) sp3- гибридизация 2) данная геометрическая форма соответствует минимуму энергии 3) углерод элемент второго периода 4)углерод находится в возбужденном электронном состоянии 23. ФОРМУЛА МОЛЕКУЛЫ С НАИБОЛЕЕ ПОЛЯРНЫМИ СВЯЗЯМИ
24. НЕВЕРНОЕ СУЖДЕНИЕ В ХАРАКТЕРИСТИКЕ МОЛЕКУЛЫ МЕТАНА 1) в процессе образования молекулы метана произошло выравнивание атомных орбиталей по форме и по размерам 2) доля s-орбитали в составе гибридной равна ¼ 3) С-Н- связь – это слабополярная и малополяризуемая связь 4) наиболее вероятен разрыв связи углерод-углерод в молекуле метана, происходящий следующим образом: CH4 ® CH3- + H+ 5) переход атома углерода в возбужденное состояние 1s22s22p2→1s22(sp3)4 6) атом углерода в основном состоянии имеет негибридные s и p –орбитали 7) гибридная орбиталь имеет форму неправильной восьмерки
25. УТВЕРЖДЕНИЕ, ПРАВИЛЬНО ОПИСЫВАЮЩЕЕ СТРОЕНИЕ МЕТИЛЬНОГО РАДИКАЛА – МЕТИЛЬНЫЙ РАДИКАЛ 1) находится в состоянии sp3-гибридизации 2) находится в состоянии sp2 – гибридизации 3) находится в состоянии sp – гибридизации 4) имеет негибридные атомные орбитали атома углерода
26. ОШИБОЧНАЯ ХАРАКТЕРИСТИКА СТРОЕНИЯ МОЛЕКУЛ И ОБЩИХ СВОЙСТВ АЛКАНОВ 1) в образовании химических связей у каждого атома углерода участвуют четыре sp3-гибридные орбитали, угол между направлениями связи равен 1090 28’, углеродная цепь не линейная, а приобретает иную форму 2) С-С связь в молекулах алканов – это s-связь, способная вращаться относительно линии, соединяющей центры атомов углерода, поэтому для алканов не характерна геометрическая изомерия 3) С-Н связь в молекулах алканов прочная, энергия С-Н связи составляет 412 кДж/моль, это в значительной степени определяет достаточную инертность алканов 4) С-Н связь в молекулах алканов является малополярной ковалентной связью 5) валентная орбиталь атома углерода – это результат гибридизации 1s и 2p орбиталей атома углерода
27. ФОРМУЛА НАИБОЛЕЕ УСТОЙЧИВОГО РАДИКАЛА
28. НАИБОЛЕЕ ВЕРОЯТНЫЙ МЕХАНИЗМ РАЗРЫВА КОВАЛЕНТНОЙ СВЯЗИ В МОЛЕКУЛАХ АЛКАНОВ 1) СН3-СН2:½СН2-СН3 2) (СH3)2HC·½·H 3)CH3-CH2-H2C½:H 4) CH3-H2C:½H
29. УГОЛ ÐClCCl В МОЛЕКУЛЕ ХЛОРОФОРМА РАВЕН 1) больше 109028’, но меньше 1200 4) 1200 2) равен 109028’ 5) немногим больше 1200 3) меньше 109028’
30. ПО ШКАЛЕ ПОЛИНГА ЭЛЕКТРОТРИЦАТЕЛЬНОСТЬ ГАЛОГЕНОВ СЛЕДУЮЩАЯ
1) Атомы F, Cl, Br более электроотрицательны, чем атом углерода. 2) Для связей С-Hal характерен гомолитический разрыв С·½·Нal ® С· + ·Нal. Реакции по замещению галогена имеют свободнорадикальный механизм 3) С-Hal связь – это полярная ковалентная s-связь. Поэтому более вероятным будет гетеролитический разрыв связи с образованием ионов С½:Hal ® C+ + Hal- 4) Радиус аниона брома больше радиуса аниона фтора, плотность заряда на F- больше, чем на Br- 5) C-Br связь легче поляризуется, чем С-F связь 6) длина связи С-Br больше, чем межъядерное расстояние С-F 7) анион фтора более устойчив, чем анион брома.
31. ОШИБКА В ХАРАКТЕРИСТИКЕ МОЛЕКУЛЫ ВЕЩЕСТВА С ФОРМУЛОЙ
1) Атом хлора, имея неподеленные пары электронов на внешнем электронном уровне в молекуле вещества представляет электрофильный центр. Это объект атаки таких частиц как OH-, H2O и других 2) Атом углерода в молекуле, и особенно углерод непосредственно связанный с хлором имеет дефицит электронной плотности. Он является объектом атаки таких частиц как NH3, атомов галогенов 3) Атом хлора в молекуле проявляет отрицательный индуктивный эффект. Его влияние по мере удаления цепи ослабевает 4) СН3-группа в молекуле вещества проявляет отрицательный индуктивный эффект
ХИМИЧЕСКИЕ СВОЙСТВА УСТАНОВИТЕ СООТВЕТСТВИЕ 32. РЕАГЕНТОВ ПРОДУКТАМ РЕАКЦИИ
33. РЕАГЕНТОВ ПРОДУКТАМ РЕАКЦИИ
34. РЕАГЕНТОВ ПРОДУКТАМ РЕАКЦИИ
35. КОНВЕРСИЯ МЕТАНА ИМЕЕТ ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ. ЭТА РЕАКЦИЯ – ИСТОЧНИК ПОЛУЧЕНИЯ ВОДОРОДА, НО ОНА ОБРАТИМА: СН4(г) + Н2О(г) (синтез-газ) ДЛЯ УВЕЛИЧЕНИЯ ВЫХОДА ПРОДУКТОВ НЕОБХОДИМО 1) повысить давление 3) понизить температуру (ниже 800 0С) 2) понизить давление
36. РЕАКЦИЯ ХЛОРИРОВАНИЯ НАЧИНАЕТСЯ С ПРОЦЕССА 1) СН4 + Сl· ® ·CH3 + HCl 4) CH4®·CH3 + ·H 2) ·CH3 + Cl2 ® CH3Cl + Сl· 5) CН3Сl + Cl·®·CH2Cl2 + HCl 3) Cl2 ® 2 Сl·
37. СРЕДИ ПРОДУКТОВ ХЛОРИРОВАНИЯ МЕТАНА НЕЛЬЗЯ ОБНАРУЖИТЬ 1) СН2Сl2 3) C2H6 6)HCl 2) CCl4 4) C2Н2Сl2
38. РЕАКЦИЯ ГАЛОГЕНИРОВАНИЯ МЕТАНА – ЦЕПНАЯ РЕАКЦИЯ. К ОБРЫВУ ЦЕПИ ПРИВОДИТ ПРОЦЕСС 1) Cl2® 2Сl· 4) ·CH3 + Cl2 ® CH3Cl + Сl· 2) Сl· + CH2Cl2 ® ·CHCl2 + HCl 5) ·CCl3 + Cl2 ®CCl4 + Сl· 3) ·CH3 + Сl· ® CH3Cl
39. ПРАКТИЧЕСКИ НЕОСУЩЕСТВИМАЯ РЕАКЦИЯ 1) СН4+Сl2 2) CH4+2Br2 3) СН4+ Сl2 4) CH4 + 2H2O
40. ТЕМПЕРАТУРА ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ МЕТАНА ВЫШЕ ТЕМПЕРАТУРЫ ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ БУТАНА ПОТОМУ, ЧТО 1) из всех алканов метан имеет самые мелкие и подвижные молекулы 2) в молекуле метана отсутствуют менее прочные углерод-углеродные связи, а энергия С-Н связей выше энергии связи между атомами углерода 3) атом углерода в метане находится в состоянии sp3 – гибридизации, что является наиболее устойчивым состоянием атома углерода 4) молекулы метана неполярны
41. ЕСЛИ В ПРОЦЕССЕ ХЛОРИРОВАНИЯ МЕТАНА В СМЕСЬ МЕТАНА С ХЛОРОМ ДОБАВИТЬ ГАЗ NO, ТО 1) увеличится скорость хлорирования, так как NO радикал 2) реакция замедлится, так как NO·+ Сl·® NOCl 3) никаких изменений не произойдет, т. к. молекула NO в реакции участия не принимает
42. НЕПРАВИЛЬНОЕ УТВЕРЖДЕНИЕ В ОПИСАНИИ МОЛЕКУЛЫ НИТРОФОРМА СН(NO2)3 1) В молекуле нитроформа нитрогруппы смещают электронную плотность от атома углерода на себя 2) Нитроформ проявляет свойства кислоты, реагируя со щелочью по уравнению: (NO2)3CH+NaOH®(NO2)3CNa+H2O 3) нитроформ – кислота, реакция со щелочью идет по схеме CH(NO2)3+NaOH®NaNO3+CH2(NO2)2
43. В РЕЗУЛЬТАТЕ КРЕКИНГА 2-МЕТИЛБУТАНА НЕ МОГУТ ОБРАЗОВАТЬСЯ 1) СН4 + С4Н8 (н-бутен) 3) С3Н8 + С2Н6 5) Н2 + С5Н10 2) С3Н8 + С2Н4 4) С2Н6 + С3Н6 44. КОЛИЧЕСТВО ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, КОТОРОЕ МОЖЕТ БЫТЬ ОБНАРУЖЕНО СРЕДИ ПРОДУКТОВ КРЕКИНГА Н-ГЕКСАНА, ПРОВЕДЕННОГО ПРИ ТЕМПЕРАТУРЕ 450 0С В ПРИСУТСТВИИ AlCl3 РАВНО 1) три 3) пять 5) семь 2) четыре 4) шесть 6) восемь
45. ПРИ КРЕКИНГЕ Н-БУТАНА НАИМЕНЕЕ ВЕРОЯТНО ОБРАЗОВАНИЕ СЛЕДУЮЩЕЙ ПАРЫ ЧАСТИЦ 1) ·СН3 и ·СН2-СН2-СН3 3) :СН3 и СН2-СН2-СН3 2) СН3-СН2· и СН3-СН2· 4) СН3-СН2-СН2-СН2· и Н·
46. КРЕКИНГ АЛКАНОВ – СПОСОБ ПОЛУЧЕНИЯ УГЛЕВОДОРОДОВ РАЗНЫХ КЛАССОВ. НАПРИМЕР СН3-СН2-СН2-СН3 1) СН3-СН3 + С2Н4 3) СН4 + СН2=СН-СН3 2) 2СН2=СН2 + Н2 4) СН3-СН=СН-СН3 + Н2
47. БРОМИРОВАНИЕ ДИМЕТИЛЭТИЛМЕТАНА ВЕДУТ ПРИ УМЕРЕННОМ НАГРЕВАНИИ (Т = 130 0С) И ОСВЕЩЕНИИ. СРЕДИ ПРОДУКТОВ ЗАМЕЩЕНИЯ ОДНОГО АТОМА ВОДОРОДА В АЛКАНЕ БУДЕТ ПРЕОБЛАДАТЬ 1) 1-бром-3-метилбутан 3) 2-бром-2-метилбутан 2) 1-бром-2-метилбутан 4) 2-бром-3-метилбутан
48. РЕАКЦИЯ ХЛОРИРОВАНИЯ ПРОПАНА НАЧИНАЕТСЯ С ПРОЦЕССА 1) Сl·½·Cl 4) CH3-CH2-CH2½:H 2) CH3-CH2-CH2·½·H
49. НАЙДИТЕ УРАВНЕНИЯ, НЕВЕРНО ОПИСЫВАЮЩИЕ ХИМИЧЕСКИЕ СВОЙСТВА ПРОПАНА В РЕАКЦИЯХ С ГАЛОГЕНАМИ 1) С3Н8 + 10F2 ® 3CF4 + 8HF 2) C3Н8 + F2 ® CH3-CHF-CH3 + HF 3) C3H8 + Cl2 4) C3H8 + Br2 5) CH3-CH2-CH3 + Cl2 6) C3H8 + I2 7) C3H8 + Br2 8) C3H8 + Cl2
50. ЭНЕРГЕТИЧЕСКИ ВЫГОДНЫЙ ПРОЦЕСС, ПРОТЕКАЮЩИЙ ПРИ ХЛОРИРОВАНИИ ПРОПАНА 1) СН3-СН2-СН3 + ·Сl ® CH3-CH2Cl-CH3 + H· 2) C3H8 + Cl· ® ·CH3 + CH3-CH2Cl
4) C3H8 + Сl· ® CH3-CH2-CH2Cl + H·
51. СРЕДИ ПРОДУКТОВ ХЛОРИРОВАНИЯ ПЕНТАНА С5Н12 + Сl2 1) 1-хлорпентан 3) С5Сl12 5) 2,2-дихлорпентан 2) 2-хлорпентан 4) C5H10Cl
52. СРЕДИ ПРОДУКТОВ НИТРОВАНИЯ 2-МЕТИЛБУТАНА ПО М.И.КОНОВАЛОВУ 1) 3-нитро-2-метилбутан 3) диметилэтилнитрометан 2) 1-нитро-2-метибутан 4) 1-нитро-3-метилбутан
53. ДЛЯ ПОЛУЧЕНИЯ 2-МЕТИЛБУТАН-2-СУЛЬФОКИСЛОТЫ НЕОБХОДИМО ВЗЯТЬ ВЕЩЕСТВА 1) H2SO4 и СН3-С(СН3)2-С2Н5 3) H2SO4 и CH3-CH2-CH(CH3)2 2) Н2SO4 и н-пентан 4) олеум и (СН3)2СН-СН(СН3)2
54. НАИБОЛЕЕ ХАРАКТЕРНЫМИ ПРОДУКТАМИ ДЛЯ РЕАКЦИИ Н-ГЕКСАН 1) С4Н10 и С2Н4 4) смесь изомеров гексана 2) С3Н8 и С3Н6 5) ненасыщенные углеводороды с шестью атомами 3) циклогексан, бензол, водород углерода в молекулах и водород
55. НАИБОЛЕЕ ВЕРОЯТНЫМИ ПРОДУКТАМИ ДЛЯ РЕАКЦИИ 1) смесь изомеров по положению двойной связи 2) алканы – изомеры по углеродной цепи 3) карбоциклические углеводороды – арены 4) алканы и алкены с более короткими углеродными цепями, чем исходное вещество
56. НЕОСУЩЕСТВИМАЯ ХИМИЧЕСКАЯ РЕАКЦИЯ 1) СН3CН2СН3 + Br2 2) CH3-CH(CH3)2 + I2
57. ОСНОВНОЙ ПРОДУКТ СЛЕДУЮЩЕЙ ХИМИЧЕСКОЙ РЕАКЦИИ
1)
58. РАССМОТРИТЕ СХЕМУ ХЛОРИРОВАНИЯ ПРОПАНА НА СВЕТУ И ОПРЕДЕЛИТЕ СХЕМУ, КОТОРАЯ ПРАВИЛЬНО ОТОБРАЖАЕТ ОДНУ ИЗ СТАДИЙ РЕАКЦИИ 1) СН3-СНСl-CH3 + Cl2 ® CH3CCl2CH3 + Сl· + ·H 3)Н+ + Сl- ® HCl 2) Cl2
59. СХЕМА, ПРАВИЛЬНО ПОКАЗЫВАЮЩАЯ РАЗРЫВ СВЯЗИ С-Н В МОЛЕКУЛЕ ИЗОБУТАНА ПРИ АТАКЕ АТОМОМ ХЛОРА 1)
60. РЕАКЦИЯ, ПРИВОДЯЩАЯ К ОБРЫВУ ЦЕПИ ПРИ БРОМИРОВАНИИ МЕТАНА 1) Br2 2) Br· + CH4 ® CH3· + HBr 5) CH3Br + Br· ® CH2Br· + HBr 3) CH3· + Br· ® CH3Br
61. ЧИСЛО МОНОХЛОРПРОИЗВОДНЫХ, КОТОРОЕ МОЖЕТ БЫТЬ ПОЛУЧЕНО ПРИ ХЛОРИРОВАНИИ 2-МЕТИЛБУТАНА РАВНО 1) трем 2) четырем 3) пяти 4) шести 5) семи
62. ПРИ БРОМИРОВАНИИ ТЕТРАМЕТИЛМЕТАНА МОЖЕТ БЫТЬ ПОЛУЧЕНО …. МОНОБРОМПРОИЗВОДНЫХ 1) одно 2) два 3) три 4) четыре 5) пять
63. ХИМИЧЕСКАЯ РЕАКЦИЯ, ПРОТЕКАЮЩАЯ С НАИБОЛЬШЕЙ СКОРОСТЬЮ 1) СН3-СНI-CH3 + AgF 3) CH3-CHCl-CH3+ AgF 2) СН3-СНBr-CH3 + AgF
64.НАИБОЛЕЕ ВЕРОЯТНЫЙ ПРОДУКТ СЛЕДУЮЩЕЙ РЕАКЦИИ 1)
65. СТАДИЯ, НЕ ПРИВОДЯЩАЯ К ОБРЫВУ ЦЕПИ В РЕАКЦИИ РАДИКАЛЬНОГО ГАЛОГЕНИРОВАНИЯ 1) Br× + Br× ® Br2 4) 2CH3×® этан 2) 3)
66. НЕСПАРЕННЫЙ ЭЛЕКТРОН В ТРЕТИЧНОМ УГЛЕВОДОРОДНОМ РАДИКАЛЕ 1) s 2) p 3) sp3 4) sp2 5) sp
67. В РЕЗУЛЬТАТЕ ИЗОМЕРИЗАЦИИ УГЛЕВОДОРОДА 1) 4)
68. НАИБОЛЕЕ ВЕРОЯТНЫЙ ПРОДУКТ СЛЕДУЮЩЕЙ РЕАКЦИИ 1)
69. ПРОМЕЖУТОЧНАЯ СТАДИЯ В ЦЕПНОЙ РЕАКЦИИ БРОМИРОВАНИЯ МЕТАНА 1) СН3× +Br×® CH3Br 3) СН3×+ Br2 ® CH3Br + Br× 2) Br2
70. ФОРМУЛА ПРОДУКТА, КОТОРЫЙ НЕ ОБРАЗУЕТСЯ ДАЖЕ В ОЧЕНЬ МАЛЫХ КОЛИЧЕСТВАХ В РЕЗУЛЬТАТЕ РЕАКЦИИ БРОМИРОВАНИЯ ЭТАНА 1) Br-CH2-CH2-Br 4) CH3CH2CH2Br 2) CH3-CH2-CH2-CH3 5) Br-CH2-CH2-CH2-CH2-Br 3) CH3-CHBr2
71. ФОРМУЛА НАИБОЛЕЕ ВЕРОЯТНОГО ПРОДУКТА СЛЕДУЮЩЕЙ РЕАКЦИИ 1) 6)
72. ФОРМУЛА МОЛЕКУЛЫ, НЕ ЯВЛЯЮЩЕЙСЯ ПРОМЕЖУТОЧНЫМ ПРОДУКТОМ ОДНОЙ ИЗ СТАДИЙ СВОБОДНО-РАДИКАЛЬНОГО ГАЛОГЕНИРОВАНИЯ 1)
НАХОЖДЕНИЕ В ПРИРОДЕ. ПОЛУЧЕНИЕ. СВЯЗЬ С ДРУГИМИ КЛАССАМИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 73. ОСНОВНОЙ КОМПОНЕНТ ПРИРОДНОГО ГАЗА 1) пропан 2) бутан 3) этан 4) метан 74. ПРИРОДНЫЙ ИСТОЧНИК МЕТАНА 1) рудничный газ 4) природный газ 2) вулканические газы 5) нефть 3) болотный газ
75. НАИБОЛЬШУЮ МАССОВУЮ ДОЛЮ УГЛЕРОДА ИМЕЕТ 1) антрацит 3) нефть 2) бурый уголь 4) природный газ
76. НАИБОЛЕЕ ВОЗМОЖНЫЙ ПУТЬ ОБРАЗОВАНИЯ МЕТАНА В ВУЛКАНИЧЕСКИХ ГАЗАХ 1) Синтез из элементов: С + 2Н2 = СН4 3) реакции карбидов с водой 2) Термическое разложение высших алкинов 4) брожение углеводов
77. УСЛОВИЕ, СПОСОБСТВУЮЩЕЕ ПОВЫШЕНИЮ ВЫХОДА МЕТАНА В РЕАКЦИИ С(тв.) + 2Н2(г) ¾ СН4(г) + 75кДж
1) Повышение температуры до 600 0С 3) Повышение давления до 100 атм. 2) Понижение давления до 50 мм рт. ст. 4) Увеличение слоя катализатора и угля
78. ЭТАН ВЫДЕЛЯЕТСЯ В РЕЗУЛЬТАТЕ РЕАКЦИИ С ВОДОЙ 1) карбида кальция 2) карбида алюминия 3) карбида магния
79.МЕТАН НЕ МОЖЕТ БЫТЬ ПОЛУЧЕН В РЕЗУЛЬТАТЕ РЕАКЦИИ 1) СН3COONa(тв.) + NaOH(тв.) 2) СаС2(тв.) + Н2О(ж) ® 5) С(тв) + Н2(г) ® 3) СО(г) + Н2(г)
80. ГИДРОГЕНИЗАЦИЯ УГЛЯ – ОДИН ИЗ СПОСОБОВ ПОЛУЧЕНИЯ АЛКАНОВ ГАЗООБРАЗНЫЕ УГЛЕВОДОРОДЫ
СМАЗОЧНЫЕ МАСЛА ПРИ ДАВЛЕНИИ 760 мм рт. ст. СОСТАВ ПРОДУКТОВ ИЗМЕНИТСЯ ТАК: 1) увеличится выход углеводородов, входящих в состав моторного топлива 2) увеличится выход смазочных масел 3) увеличится выход газообразных углеводородов 4) уменьшится содержание в составе продукта непредельных углеводородов
81. УКАЖИТЕ НАИБОЛЕЕ ВЕРОЯТНЫЕ ПРОДУКТЫ КРЕКИНГА ГЕКСАДЕКАНА ПРИ УКАЗАННЫХ УСЛОВИЯХ С16Н34 1) С и Н2 3) углеводороды С4-С10 нормального и изомерного строения и Н2 2) С8Н16 и Н2 4) С8Н18 и С8Н16
82. ЕСЛИ В КАЧЕСТВЕ КАТАЛИЗАТОРА КРЕКИНГА ГЕКСАДЕКАНА ИСПОЛЬЗОВАТЬ БЕЗВОДНЫЙ AlCl3, ТО СОСТАВ ПРОДУКТОВ ИЗМЕНИТСЯ СЛЕДУЮЩИМ ОБРАЗОМ 1) увеличится содержание углеводородов изомерного строения 2) увеличится содержание непредельных углеводородов 3) увеличится содержание газообразных углеводородов 4) увеличится содержание бензола, толуола, ксилола 5) увеличится содержание углеводородов нормального строения
УСТАНОВИТЕ СООТВЕТСТВИЕ 83. А) К ОБРАЗОВАНИЮ 2,3-ДИМЕТИЛБУТАНА ПРИВЕДЕТ РЕАКЦИЯ Б) К ОБРАЗОВАНИЮ 2,3,4-ТРИМЕТИЛПЕНТАНА ПРИВЕДЕТ РЕАКЦИЯ

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|


 ПО ПРАВИЛАМ ЗАМЕСТИТЕЛЬНОЙ НОМЕНКЛАТУРЫ IUPAC НАЗЫВАЕТСЯ
ПО ПРАВИЛАМ ЗАМЕСТИТЕЛЬНОЙ НОМЕНКЛАТУРЫ IUPAC НАЗЫВАЕТСЯ








 РАВНО
РАВНО НАЗЫВАЕТСЯ
НАЗЫВАЕТСЯ 2)
2)  3)
3)  4)
4)  5)
5) 
 НАЗЫВАЕТСЯ
НАЗЫВАЕТСЯ 2)
2)  3)
3)  4)
4)  5)
5) 
 Б)
Б)  В)
В)  Г) СН3СН3 Д) С9Н20 Е) С15Н32
Г) СН3СН3 Д) С9Н20 Е) С15Н32
 Б)
Б)  В)
В)  Г)
Г)  Д)
Д)  Е)
Е) 


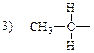

 ДЛЯ СРАВНЕНИЯ (С=2,5). ОПРЕДЕЛИТЕ ОШИБОЧНОЕ УТВЕРЖДЕНИЕ, ХАРАКТЕРИЗУЮЩЕЕ СВЯЗИ С-F, C-Cl, C-Br.
ДЛЯ СРАВНЕНИЯ (С=2,5). ОПРЕДЕЛИТЕ ОШИБОЧНОЕ УТВЕРЖДЕНИЕ, ХАРАКТЕРИЗУЮЩЕЕ СВЯЗИ С-F, C-Cl, C-Br.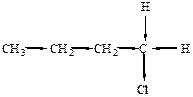
 Б)
Б)  В)
В)  Г)
Г)  Д)
Д) 
 2)
2)  3) СО2 + Н2О
4)
3) СО2 + Н2О
4)  5) СН3Br
5) СН3Br
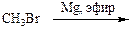 Б)
Б)  В)
В)  Г)
Г) 
 2)
2)  3)
3)  4) СН3MgBr
5)
4) СН3MgBr
5)  6) CH3ОН
7)
6) CH3ОН
7) 
 Б)
Б)  В)
В)  Г) СН3Br + (CH3)2NH ®
Г) СН3Br + (CH3)2NH ®
 3)
3)  4)
4)  5)
5)  6)
6)  7)
7) 
 СО(г) +3Н2
СО(г) +3Н2 CH3Cl + HCl 5) CH4+I2
CH3Cl + HCl 5) CH4+I2  CH3I + HI
CH3I + HI CH2Br2 +2HBr 6) CH2Cl2 + Cl2
CH2Br2 +2HBr 6) CH2Cl2 + Cl2  CHCl3+HCl
CHCl3+HCl CН3Сl +HCl 7) CH4 + HNO3
CН3Сl +HCl 7) CH4 + HNO3  CH3NO2 +H2O
CH3NO2 +H2O CO2+4H2
CO2+4H2
 . К КРЕКИНГУ НЕЛЬЗЯ ОТНЕСТИ ОБРАЗОВАНИЕ СЛЕДУЮЩИХ ПРОДУКТОВ
. К КРЕКИНГУ НЕЛЬЗЯ ОТНЕСТИ ОБРАЗОВАНИЕ СЛЕДУЮЩИХ ПРОДУКТОВ
 6) Cl½:Cl
6) Cl½:Cl CH3-CHCl-CH3 + HCl
CH3-CHCl-CH3 + HCl CH3CH2CH2Br + HBr
CH3CH2CH2Br + HBr CH3-CHBr-CH3 + HBr
CH3-CHBr-CH3 + HBr C3H7Cl + HCl
C3H7Cl + HCl
 БУДЕТ ПРЕОБЛАДАТЬ
БУДЕТ ПРЕОБЛАДАТЬ ЯВЛЯЮТСЯ
ЯВЛЯЮТСЯ ЯВЛЯЮТСЯ
ЯВЛЯЮТСЯ
 + Br2
+ Br2 
 + Сl2
+ Сl2 
 2)
2)  3)
3)  4)
4) 
 + H+
+ H+ 2)
2)  3)
3) 
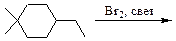
 2)
2)  3)
3)  4)
4)  5)
5) 
 5)
5) 

 НАХОДИТСЯ НА ОРБИТАЛИ
НАХОДИТСЯ НА ОРБИТАЛИ НАИБОЛЕЕ ЛЕГКО РАЗРЫВАЕТСЯ УГЛЕРОД УГЛЕРОДНАЯ СВЯЗЬ
НАИБОЛЕЕ ЛЕГКО РАЗРЫВАЕТСЯ УГЛЕРОД УГЛЕРОДНАЯ СВЯЗЬ 2)
2)  3)
3) 
 5)
5) 
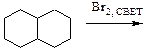
 2)
2)  3)
3) 
 2 Br×4) СН3×+ СН3× ® CH3-CH3
2 Br×4) СН3×+ СН3× ® CH3-CH3
 2)
2)  3)
3)  4)
4)  5)
5) 

 2)
2)  3)
3)  4)
4) 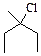 5)
5) 

 Н2(г) Ni, Fe, C CH4(г)
Н2(г) Ni, Fe, C CH4(г) 4) Li4C(тв) + Н2О(ж) ®
4) Li4C(тв) + Н2О(ж) ®

 УГОЛЬ + Н2
УГОЛЬ + Н2  МОТОРНОЕ ТОПЛИВО
МОТОРНОЕ ТОПЛИВО ?
?


