
|
|
Опыт 2. Определение энергии активации реакции разложения тиосерной кислоты.Исследование кинетики реакции разложения тиосерной кислоты Цель работы:определить порядок и энергию активации реакции разложения тиосерной кислоты. Теоретическая часть В задачи химической кинетики входит исследование скоростей и механизмов реакций, а также зависимость скорости от различных факторов. Результатом этих исследований является определение порядка, константы скорости и энергии активации реакции, а также числа и характера промежуточных продуктов. Эти знания позволяют на практике управлять химическим процессом. Средняя скорость для гомогенной химической реакции при постоянном объеме определяется как изменение концентрации одного (i) из исходных веществ или продуктов реакции в единицу времени:
Предел этой средней скорости при Δτ → 0 называется истинной скоростью химической реакции в определенный момент времени τ:
Зависимость скорости химической реакции от концентраций реагентов определяется законом действующих масс: скорость реакции пропорциональна произведению концентраций реагирующих веществ Сi в некоторых степенях i, определяемых экспериментально. Например, зависимость скорость элементарной химической реакции aA + bB = dD + сС от концентраций реагирующих веществ описывается следующим уравнением:
которое называют кинетическим уравнением химической реакции, где k - коэффициент пропорциональности, CAи CB– концентрации веществ A и В соответственно, выраженные в моль/л, а и b – определяемые экспериментально коэффициенты. Коэффициент пропорциональности k в уравнении скорости реакции называется константой скорости химической реакции, а – это экспериментально определяемый показатель степени при концентрации компонента A, который называется частным кинетическим порядкомреакции по компоненту A. Для элементарных реакций частные порядки совпадают с коэффициентами перед реагентами в химическом уравнении реакции, а общий порядок равен сумме коэффициентов в левой части уравнения реакции. Существуют реакции нулевого, первого, второго и третьего порядков. Для сложных реакций общий кинетический порядок не совпадает с коэффициентами перед реагентами в химическом уравнении. Кинетический порядок реакции определяют экспериментально с использованием интегрального и дифференциального методов. Константа скорости химической реакции зависит от температуры. Эту зависимость определяет уравнение Аррениуса:
где Eа – энергия активации процесса (Дж/моль), А – предэкспоненциальный множитель, величина которого (как и Eа) характерна для каждой реакции; R – универсальная газовая постоянная, равная 8,314 Дж/(моль·K); T – температура, К. Энергия активации как кинетическая характеристика очень важна. Когда значение Eaмало (не более 25 Дж/моль), это значит, что процесс протекает с диффузионным контролем, т.е. диффузия – самая медленная стадия всего процесса. Если значение Eaбольше 45 Дж/моль, можно сделать вывод, что самой медленной стадией является сама химическая реакция. Если скорость химической реакции зависит от концентрации только одного компонента и порядок ее по этому компоненту имеет небольшое целочисленное значение, для обработки экспериментальных данных часто пользуются уравнением скорости химической реакции, полученным интегрированием выражения:
Для реакции первого порядка (n = 1) получаем:
где С0 – исходная концентрация вещества, по которому определяется порядок реакции, моль/л; С – концентрация вещества в момент времени τ, моль/л; k – константа скорости данной реакции. Если все значения k, вычисленные в различные моменты времени по выше описанной формуле, одинаковы, то исследуемая реакция имеет действительно первый порядок. Наряду с константой скорости реакции для характеристики скорости реакции первого порядка часто пользуются временем, или периодом полупревращения t1/2. Период полупревращения – это промежуток времени, в течение которого прореагирует половина исходного количества вещества. Подставив в уравнение для определения константы скорости τ = τ1/2 и С = С0/2 и решив его относительно τ1/2, получим, что период полураспада связан с константой скорости реакции первого порядка соотношением:
Определение порядков реакции.Реакции первого порядка редко встречаются в реальных химических системах. Гораздо чаще кинетика химической реакции описывается уравнением, в котором порядок реакции не является целым числом и скорость реакции зависит от концентрации не одного, а нескольких реагентов. Для такой реакции кинетическое уравнение имеет следующий вид:
где a, b, с... – порядки реакции по компонентам А, В и С. Исследование таких реакций затруднено тем, что концентрации всех реагирующих веществ изменяются во времени. В то же время, для того чтобы определить порядок реакции, нужно наблюдать зависимость скорости реакции от концентрации каждого реагента по отдельности. Этого можно добиться, если все реагенты, кроме одного, будут находиться в реакционной смеси в большом избытке (в 10 и более раз). Тогда расходованием их в процессе реакции можно пренебречь и считать постоянными. В этом случае предыдущее уравнение упрощается до Логарифмирование этого уравнения дает уравнение прямой в координатах ln υ – ln CA:
Тангенс угла наклона этой прямой к оси равен порядку реакции по веществу А:
Подобным же образом можно определить порядки реакции по остальным реагентам. Определение энергии активациипроводят путем исследования зависимости константы скорости реакции от температуры в соответствии с уравнением Аррениуса. Логарифмированием его преобразуют к виду:
то есть к уравнению прямой в координатах ln k – 1/Т, угловой коэффициент которой (тангенс угла наклона) равен Ea/R. Согласно уравнению закона действия масс при постоянных концентрациях реагентов константа скорости и скорость реакции прямо пропорциональны друг другу. Это означает, что энергию активации химической реакции можно определить графически из зависимости ln υ от 1/Т.
Другой способ определения энергии активации заключается в интегрировании уравнения
Зная значения констант скоростей при двух определенных температурах, по этому уравнению можно вычислить энергию активации. Экспериментальная часть Так как тиосерная кислота неустойчива и самопроизвольно разлагается с образованием свободной серы по реакции H2S2O3 = H2O + SO2 + S, ее получают непосредственно в эксперименте при взаимодействии тиосульфата натрия с серной кислотой: Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4, S2O32– + 2H+= H2S2O3
Реакция взаимодействия тиосульфата натрия с серной кислотой протекает мгновенно и на скорость реакции разложения тиосерной кислоты не влияет. Тогда средняя скорость исследуемой реакции может быть рассчитана по уравнению:
Концентрацию в этом уравнении можно определить по исходной концентрации тиосульфата натрия c учетом изменения объема реакционной смеси (вследствие добавления H2O и H2SO4). О количестве разложившейся H2S2O3 (ΔC (H2S2O3)) удобно судить по плотности образовавшейся суспензии серы. В начале опыта раствор является полностью прозрачным. После появления суспензии серы жидкость постепенно мутнеет. Если во всех опытах отсчет времени проводить до одинаковой плотности суспензии серы, то изменение концентрации тиосерной кислоты ΔC (H2S2O3) в них можно считать постоянным. Вследствие этого при графическом определении порядка и энергии активации вместо скорости реакции можно воспользоваться пропорциональной ей величиной Для удобства определения координат точек по оси 1/Т их численные значения следует умножать на постоянный множитель 1000 и строить график в координатах
Опыт 1. Определение порядка реакции разложения тиосерной кислоты.Раствор тиосульфата натрия необходимо готовить непосредственно перед опытом, так как он неустойчив и быстро разлагается на свету. 1.1. Налейте в чистую пробирку 3 мл 0,2 М раствора тиосульфата натрия, а во вторую пробирку – 3 мл 0,2 М раствора серной кислоты. Быстро перелейте раствор серной кислоты в пробирку с раствором тиосульфата натрия. В момент сливания растворов включите секундомер и перемешайте раствор палочкой, опустив ее 2–3 раза до дна пробирки. Выньте палочку из раствора. Наблюдайте за прозрачностью раствора. В момент, когда раствор перестает быть прозрачным, остановите секундомер. Время опыта занесите в таблицу 1. 1.2. Повторите эксперимент 1.1 с концентрацией Na2S2O3 меньшей в 0,3 раза. Для этого в пробирку перенесите 2,5 мл раствора тиосульфата натрия и 0,5 мл дистиллированной воды. Количество кислоты возьмите то же. Результаты опыта занесите в таблицу 1. 1.3. Повторите эксперимент 1.1 с концентрацией Na2S2O3 меньшей в 1,5 раза. Для этого в пробирку перенесите 2 мл раствора тиосульфата натрия и 1 мл дистиллированной воды. Количество кислоты возьмите то же. Результаты опыта занесите в таблицу 1. 1.4. Повторите эксперимент 1.1 с концентрацией Na2S2O3 меньшей в 2 раза. Для этого в пробирку перенесите 1,5 мл раствора тиосульфата натрия и 1,5 мл дистиллированной воды. Количество кислоты возьмите то же. Результаты опыта занесите в таблицу 1. 1.5. Повторите эксперимент 1.1 с концентрацией Na2S2O3 в 3 раза меньшей. Для этого возьмите 1 мл 0,2 М раствора Na2S2O3 и 2 мл дистиллированной воды. Результаты опыта занесите в таблицу 1. 1.6. Эксперимент 1.1 повторите еще раз, уменьшив концентрацию Na2S2O3 в 4 раза. Для этого в пробирку перенесите 0,75 мл раствора тиосульфата натрия, 2,25 мл дистиллированной воды и 3 мл кислоты. Результаты опыта занесите в таблицу 1, отметив температуру.
Таблица 1
На основе данных таблицы 1 постройте график в координатах Определите по графику порядок реакции разложения тиосерной кислоты по тангенсу угла наклона этой прямой к оси. Сделайте заключение о порядке реакции. Опыт 2. Определение энергии активации реакции разложения тиосерной кислоты. 2.1. Налейте в пробирку 1,5 мл приготовленного 0,2 М раствора тиосульфата натрия и 1,5 мл воды; в другую пробирку – 3 мл раствора серной кислоты. Быстро перелейте раствор серной кислоты в пробирку и перемешайте его палочкой, опустив ее 2–3 раза до дна пробирки. В момент сливания растворов включите секундомер. Отметьте время, когда раствор перестает быть прозрачным, и запишите его в таблицу 2. Запишите в таблицу 2 и комнатную температуру. 2.2. Подготовьте пробирку 1,5 мл 0,2 М раствора тиосульфата натрия и 1,5 мл воды и пробирку с 3 мл раствора серной кислоты, как в эксперименте 2.1. Поместите пробирки в воду, нагретую до ~30 °C на 5–7 мин. Не вынимая пробирку с тиосульфатом натрия из воды, перелейте в нее раствор из пробирки с серной кислотой и перемешайте. Одновременно включите секундомер и отметьте время помутнения раствора. Температуру и время запишите в таблицу 2. 2.3. Повторите эксперимент 2.1 при температуре ~40 °С. Занесите результат в таблицу 2. 2.4. Повторите эксперимент 2.1 при температуре ~50 °С. Время и температуру опыта внесите в таблицу 2. Таблица 2
Определите энергию активации и предэкспоненциальный множитель реакции, построив график зависимости скорости реакции (ln υ) от обратной температуры (1/T) на основе данных таблицы 2. Определение энергии активации проведите двумя методами: 1. По уравнению 2. По экспериментальным значениям двух соседних точек, используя уравнения:
где T1,T2 ,τ1, τ2 – значения двух пар соседних точек. Найдите среднее значение энергии активации:
Предэкспоненциальный множитель определите по формуле:
Сделайте заключение по полученным данным. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
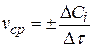


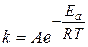

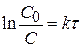 или
или 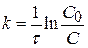


 , где
, где 




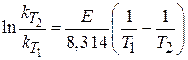

 и представлять экспериментальные данные в координатах
и представлять экспериментальные данные в координатах  при определении порядка реакции, и в координатах
при определении порядка реакции, и в координатах  при определении энергии активации.
при определении энергии активации.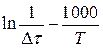 .
.
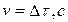

 , где b – отрезок прямой на оси ординат, a – отрезок прямой на оси абсцисс.
, где b – отрезок прямой на оси ординат, a – отрезок прямой на оси абсцисс.


