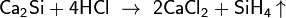|
|
Список использованных источниковВведение Кремний – один из самых распространенных в земной коре элементов. Он составляет 27,5% масс. доступной нашему исследованию части земной коры, занимая по распространенности второе место после кислорода. Соединения крения, широко распространенные на земле, были известны человеку с каменного века. Использование каменных орудий для труда и охоты продолжалось несколько тысячелетий. Применение соединений Кремния, связанное с их переработкой (изготовление стекл) началось около 3000 лет до н. э. (в Древнем Египте). В природе кремний встречается только в соединениях в виде диоксида кремния SiO2, называемого также кремниевым ангидридом или кремнеземом, и в виде солей кремниевых кислот(силикатов). Входя в состав всех органических веществ, является важнейшим элементом растительного и животного царства. Химический элемент кремний Si расположен в третьем периоде, в главной подгруппе IV группы периодической системы. Он является электронным аналогом углерода и, подобно ему, в большинстве соединений четырехвалентен Наибольшее применение кремний находит в производстве сплавов для придания прочности алюминию, меди и магнию и для получения ферросилицидов, имеющих важное значение в производстве сталей и полупроводниковой техники. Кристаллы кремния применяют в солнечных батареях и полупроводниковых устройствах – транзисторах и диодах. Кремний служит также сырьем для производства кремнийорганических соединений, или силоксанов, получаемых в виде масел, смазок, пластмасс и синтетических каучуков. Неорганические соединения кремния используют в технологии керамики и стекла, как изоляционный материал и пьезокристаллы.
Физические свойства кремния Компактный кремний – вещество серебристо-серого цвета с металлическим. блеском. Кристаллическая решетка устойчивой модификации кубическая. гранецентрированная типа алмаза. При высоких давлениях существуют другие. полиморфные модификации: при 20 ГПа – кремний Iс тетрагональной решеткой (а=0,4686 нм, с=0,2585 нм), выше 20 ГПа – кремний II с кубической (а=0,644 нм) и кремний III с гексагональной (а=0,380 нм, с=0,628 нм). При кристаллизации из газовой фазы на поверхностях с температурой ниже 600°С образуется аморфный кремний. Для кристаллического кремния температура плавления составляет 1415 °С (плавится с уменьшением объема на 9%), температура кипения – 3249 °С; плотность – 2,33 г/см3; молярная теплоемкость – 20,16 Дж/(моль.К); энтальпия плавления – 49,9 кДж/моль, энтальпия испарения – 445,2 кДж/моль; энтропия(298 К) 18,9 Дж/(моль.К); давление пара – 0,046 Па (1415 °С); температурный коэффициент линейного расширения – 3,72*106 и 0,6*106 К-1 (84 К); теплопроводность – 95,5 Вт/(м*К); температура Дебая 645 К; диамагнетик, магнитная восприимчивость – 3,9*106. При обычных условиях кремний хрупок, выше 800 °С становится пластичным. Кремний прозрачен для ИК излучения при длинах волн l>1 мкм; коэффициент преломления 3,565 (l=1,05 мкм), 3,443 (l=2,6 мкм), 3,45 (l = 2,1 мкм); отражательная способность 0,3 (l>1,5 мкм). Кремний – полупроводник; ширина запрещенной зоны 1,21 эВ при температуре около 0 К и 1,09 эВ при 300 К; концентрация носителей тока в кремнии с собственной проводимостью 1,5-1016 м3 (300 К); температурная зависимость подвижности электронов и дырок [м2/(В.с)] определяется соотв. выражениями: mn=4,0.105Т2,6 (300[T[400 К) и mр = 2,5.104T2,3 (150[T[400 К); при 300 К mn= 0,145 м2/(В.с), mp=0,048 м2/(В.с), коэффициент диффузии электронов 3,5*103 м2/с, дырок – 1,3*10-3 м2/с. Электрофизические свойства кремния зависят от природы и концентрации присутствующих примесей и структурных дефектов. Для получения монокристаллов кремния с дырочной проводимостью используют легирующие добавки В, Al, Ga, In (акцепторные примеси), с электронной проводимостью – Р, As, Sb (донорные примеси). Примеси Аu, Сu, Fe, Mn, V и некоторые другие существенно снижают время жизни носителей тока в монокристаллах кремния. Максимальная растворимость примесей в кремнии наблюдается при 1200-1300°С и может быть грубо оценена по значению коэффициента. распределения между твердым кремнием и его расплавом. Акцепторные примеси в кремнии имеют большие значения коэффициента диффузии, чем донорные. Ряд примесей (Li, Сu, Аu) диффундирует по междоузлиям кристаллической решетки с очень высокими скоростями. Для определения содержания примесей в кремнии высокой чистоты используют прецизионные методы: спектральный и активационный анализ, метод ЭПР и др. Производят монокристаллы кремния без дислокаций диаметром до 0,156 м. Основные дефекты в таких монокристаллах кремния – скопления собственных междоузельных атомов, вакансий и атомов остаточных примесей. Для определения природы и содержания структурных дефектов в кремнии применяют избирательное травление (в основном смесью кислот: HF, HNO3 и СН3СООН), рентгеновский и др. методы. Электрические свойства кремния могут сильно изменяться при термической обработке. Так, нагревание монокристаллов, содержащих кислород, до 400–500 °С приводит к увеличению электронной проводимости, а при послед. нагревании до 1000-1200 °С этот эффект пропадает. Обычно термическая обработка приводит к существенному снижению времени жизни носителей тока. Для предотвращения вредного действия термической обработки используют предварительную обработку поверхности монокристаллов кремния специальными органическими реактивами, отжиг в хлорсодержащей атмосфере, грубую шлифовку, бомбардировку ионами и др. методы. При низких температурах кремний химически инертен, при нагревании его реакционная способность резко возрастает. Особенно активен расплавленный кремний. Координационное число атома кремния 4, иногда 6 (например во фторосиликатах, содержащих анион [SiF6]2-). Соединения, где кремний формально двухвалентен, по-видимому, содержат связь Si—Si и, как правило, полимерны. Благодаря образующейся на поверхности защитной оксидной пленке кремний устойчив на воздухе даже при повышенных температурах. Окисляется кислородом выше 400°С до SiO2. Стоек к действию кислот, взаимодействует только со смесью HNO3 и фтористоводородной кислоты. С парами S при 600 °С дает дисульфид SiS2, который выше 600 °С переходит в моносульфид SiS
Аллотропные модификации кремния Аллотропия (от др.-греч. αλλος – «другой», τροπος – «поворот, свойство») – существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам – так называемых аллотропных модификаций или форм. Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы). Кристаллический кремний Кристаллический кремний – это основная форма, в которой используется кремний при производстве фотоэлектрических преобразователей и твердотельных электронных приборов методами планарной технологии. Активно развивается использование кремния в виде тонких плёнок (эпитаксиальных слоёв) кристаллической и аморфной структуры на различных подложках. Темно-серое вещество с металлическим блеском, большая твердость, хрупкость, полупроводник, инертен. В зависимости от предназначения различают: 1 Кремний электронного качества (т. н. «электронный кремний») – наиболее качественный кремний с содержанием кремния свыше 99,999 % по весу, более высокими показателями по времени жизни (свыше 25 мкс), используемый для производства твердотельных электронных приборов, микросхем и т. п. Удельное электрическое сопротивление кремния электронного качества может находиться в интервале примерно от 0,001 до 150 Ом·см, но при этом величина сопротивления должна быть обеспечена исключительно заданной примесью т. е. попадание в кристалл других примесей, хотя бы и обеспечивающих заданное удельное электрическое сопротивление, как правило, недопустимо. Основная масса кристаллов кремния электронного качества является т.н. "бездислокационными кристаллами", т. е. плотность дислокаций в них не превышает 10 см−2, однако, в некоторых случаях, для изготовления электронных приборов также применяются слитки с двойниковой или даже поликристаллической структурой. 2 Кремний солнечного качества (т. н. «солнечный кремний») – кремний с содержанием кремния свыше 99,99 % по весу, со средними значениями времени жизни неравновесных носителей и удельного электросопротивления (до 25мкс и до 10 Ом.см), используемый для производства фотоэлектрических преобразователей (солнечных батарей); 3 Технический кремний – блоки кремния поликристаллической структуры, полученного методом карботермического восстановления из чистого кварцевого песка; содержит 98 % кремния, основная примесь – углерод, отличается высоким содержанием легирующих элементов – бора, фосфора, алюминия; в основном используется для получения поликристаллического кремния; в 2006–2009 гг. в связи с дефицитом кремниевого сырья солнечного качества предпринимались попытки использования этого материала для производства кристаллического кремния солнечного качества: для этого производилась доочистка технического кремния путём дробления по межкристаллитным границам и стравливания примесей, концентрирующихся на границах, затем производилась перекристаллизация одним из вышеупомянутых способов). В зависимости от способа перекристаллизации различают: – кремний монокристаллический — цилиндрические слитки кремния моно- и поликристаллической структуры с диаметром до 400 мм, полученные методом Чохральского. В монокремнии кристаллическая структура однородна, без границ зерен (что заметно даже по внешнему виду). Упорядоченное расположение атомов кремния в монокристаллической решетке кремния создает четкую зонную структуру. Каждый атом кремния имеет 4 электрона на внешней оболочке. Электроны соседних атомов образуют пары, принадлежащие обоим атомам одновременно, таким образом, каждый атом имеет 4 связи с соседними атомами. Поведение монокристаллического кремния хорошо предсказуемо, однако, из-за низкой скорости роста и сложности процесса производства он является самым дорогостоящим видом кремния. Монокристаллический кремний является основой современной электронной техники. К нему предъявляются чрезвычайно высокие требования по чистоте и совершенству структуры. Концентрации электрически активных легирующих примесей обычно находятся в пределах 1013–1018 см³, электрически активных фоновых примесей — менее 1015 см³, а электрически неактивных примесей – менее 1018–1019 см³. Основными типами структурных дефектов являются так называемые микродефекты. Как правило, они представляют собой мелкие дислокационные петли или кластеры собственных и примесных точечных дефектов. – кремний монокристаллический бестигельный – цилиндрические слитки кремния монокристалической структуры с диаметром до 150 мм, полученные методом бестигельной зонной плавки; – мультикремний — прямоугольные блоки кремния поликристаллической структуры с размерами до 1000х1000х600мм, полученные методом направленной кристаллизации в контейнере. Занимает промежуточное положение между поли- и мнокристаллическим кремнием по размеру и количеству кристаллов. Вырастить мультикристаллы кремния гораздо проще, чем монокристаллы, поэтому их стоимость ниже. Однако, качество мультикристалла по сравнению с монокристаллом также ниже из-за наличия множества границ зерен монокристаллов, из которых состоит мультикристалл. Границы зерен создают дополнительные дефектные уровни в запрещенной зоне полупроводника, являясь локальными центрами с высокой скоростью рекомбинации, что приводит к уменьшению общего времени жизни неосновных носителей. Кроме того границы зерен уменьшают производительность препятствуя току носителей и создавая шунтирующие пути для тока, текущего через p-n переход. Чтобы избежать слишком больших рекомбинационных потерь на границах зерен, размер зерен должен быть как минимум несколько миллиметров. Это условие также означает, что размеры одного зерна будут больше, чем толщина солнечного элемента, что уменьшит сопротивление току носителей и общую протяженность пограничных областей в солнечном элементе. Такой мультикристалличнеский кремний широко используется в коммерческих солнечных элементах. – поликремний представляет собой высокочистый кремний с содержанием примесей менее 0,0001 %, состоящий из большого числа небольших кристаллических зерен, ориентированных друг относительно друга хаотически. По сути, технический кремний тоже является поликристаллическим, однако, во избежание путаницы, понятие «поликристаллический кремний» применяется только к особо чистому полупроводниковому кремнию. Поликремний — наиболее чистая форма промышленно производимого кремния и основной материал для микроэлектроники и солнечной энергетики – полуфабрикат, получаемый очисткой технического кремния хлоридными методами и используемый для производства моно- и мультикристаллического кремния. В настоящее время различают поликремний «электронного» (полупроводникового) качества (содержанием примесей менее 1·10-10 %) и поликремний «солнечного» качества (содержанием примесей менее 1·10-5 %).Большая часть поликристаллического кремния в мире производится в форме цилиндрических стержней серого цвета с шершавой дендритной поверхностью. В центре стержня находится «затравка» из моно- или поликремния круглого или квадратного сечения диаметром (стороной) 8–10 мм. От «затравки» перпендикулярно к образующей прорастают плотноупакованные кристаллиты в виде коротких игл, с сечением менее 1 мм. Поликремний является сырьем для производства более совершенных видов кремния – мультикристаллического кремния (мультикремния) и монокристаллического кремния (монокремния), а также в некоторых сферах применения может использоваться в чистом виде. –. кремниевый скрап — обрезки, обломки и другие чистые отходы производства кремния описанными выше методами без следов окисления, вплавленных частей тигля либо футеровки – в свою очередь может быть разделён на подгруппы в зависимости от происхождения– используется в качестве оборотного сырья при производстве кристаллического кремния; –. umg-скрап – металлургически очищенный технический кремний – это технический кремний подвергнутый доочистке путём взаимодействия кремниевого расплава с другими веществами (для экстракции примесей либо перевода их в нерастворимую или газообразную фазу и т.п.) и после дующей направленной кристаллизации и последующим удалением зоны концентрирования загрязнений; –. рot-скрап – осколки, обрезки и другие отходы производства кристаллического кремния описанными выше способами с остатками тиглей либо футеровки, следами окисления, шлака– как правило это также та область, куда при кристаллизации оттеснялись примеси–наиболее грязный кремний– в свою очередь может быть разделён на подгруппы в зависимости от происхождения– после очистки от вкраплений посторонних веществ может использоваться как добавка к оборотному сырью при получении марок кремния с пониженными требованиями к качеству. Кремний монокристаллический бестигельный производится только электронного качества. Мультикремний производится только солнечного качества. Монокристаллический кремний, трубы и ленты получаемые методом Чохральского могут быть как электронного, так и солнечного качества. Аморфный кремний Бурый или коричневый порошок, сильно гигроскопичный, химически более активен, чем кристаллический. При обыкновенной температуре непосредственно реагирует с фтором, образуя фтористый кремний SiF4, при высокой температуре реагирует почти со всеми неметаллами и со многими металлами. Координационное число кремния равно четырем, поэтому в кристалле каждый атом кремния связан с четырьмя соседними атомами. В кристаллическом кремнии эти тетраэдрические структуры продолжаются в широком диапазоне, образуя хорошо упорядоченную кристаллическую решетку. В аморфном кремнии это дальнего порядка нет, и структура порядка атомных позиций ограничивается короткой дистанцией. Скорее всего, атомы образуют непрерывные случайные сети. Кроме того, не все атомы в аморфном кремнии четыре раза скоординированы. В связи с неупорядоченным характером материала некоторые атомы имеют оборванные связи. Физически эти оборванные связи представляют собой дефекты в непрерывной случайной сети и значительно изменяют свойства кремния. В полупроводниковых приборах аморфный кремний используется обычно в виде тонких пленок, осажденных на подложку. В солнечных элементах используются слои гидрогенизированного аморфного кремния, в котором значительная часть оборванных связей заполнена атомами водорода. Такой кремний показывает лучший коэффициент преобразования света в электроэнергию по сравнению с чистым аморфным кремнием. Аморфный кремний во многом похож на углерод. Реакционная способность аморфного кремния выше, чем кристаллического. Получение Наиболее простым и удобным лабораторным способом получения кремния является восстановление оксида кремния SiO2 при высоких температурах металлами-востановителями. Вследствие устойчивости оксида кремния для восстановления применяют такие активные восстановители, как магний и алюминий:3SiO2 + 4Al = 3Si + 2Al2O3При восстановлении металлическим алюминием получают кристаллический кремний. Способ восстановления металлов из их оксидов металлическим алюминием открыл русский физикохимик Н.Н. Бекетов в 1865 году. При восстановлении оксида кремния алюминием выделяющейся теплоты не хватает для расплавления продуктов реакции – кремния и оксида алюминия, который плавится при 2050 С. Для снижения температуры плавления продуктов реакции в реакционную смесь добавляют серу и избыто алюминия. При реакции образуется легкоплавкий сульфид алюминия:2Al + 3S = Al2S3 Капли расплавленного кремния опускаются на дно тигля.Кремний технической чистоты (95—98%) получают в электрической дуге восстановлением кремнезёма SiO2 между графитовыми электродами.SiO2+2C=Si+2COВ связи с развитием полупроводниковой техники разработаны методы получения чистого и особо чистого кремния. Это требует предварительного синтеза чистейших исходных соединений кремния, из которых кремний извлекают путём восстановления или термического разложения. Чистый полупроводниковый кремний получают в двух видах: поликристаллический (восстановлением SiCI4 или SiHCl3 цинком или водородом, термическим разложением Sil4 и SiH4) и монокристаллический (бестигельной зонной плавкой и «вытягиванием» монокристалла из расплавленного кремния – метод Чохральского).Старейшим методом разложения тетрахлорида кремния является метод выдающегося русского химика академика Н.Н.Бекетова. Метод этот можно представить уравнением:SiCl4+Zn=Si+2ZnCl2.Здесь пары тетрахлорида кремния, кипящего при температуре 57,6°C, взаимодействуют с парами цинка. В настоящее время тетрахлорид кремния восстанавливают водородом. Реакция протекает по уравнению:SiCl4+2Н2=Si+4НCl.Кремний получается в порошкообразном виде. Применяют и йодидный способ получения кремния, аналогичный описанному ранее йодидному методу получения чистого титана. Химические свойства Подобно атомам углерода, для атомов кремния является характерным состояние sp3-гибридизации орбиталей. В связи с гибридизацией чистый кристаллический кремний образует алмазоподобную решётку, в которой кремний четырёхвалентен. В соединениях кремний обычно также проявляет себя как четырёхвалентный элемент со степенью окисления +4 или −4. Встречаются двухвалентные соединения кремния, например, оксид кремния (II) — SiO. При нормальных условиях кремний химически малоактивен и активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствии кислорода, воздуха или воды (водяных паров). При нагревании до температуры свыше 400—500 °C кремний реагирует с кислородом с образованием диоксида SiO2, процесс сопровождается увеличением толщины слоя диоксида на поверхности, скорость процесса окисления лимитируется диффузией атомарного кислорода сквозь плёнку диоксида. При нагревании до температуры свыше 400—500 °C кремний реагирует с хлором, бромом и йодом – с образованием соответствующих легко летучих тетрагалогенидов SiHal4 и, возможно, галогенидов более сложного состава. С водородом кремний непосредственно не реагирует, соединения кремния с водородом –силаны с общей формулой SinH2n+2 – получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—). С азотом и бором кремний реагирует при температуре около 1000 °C, образуя соответственно нитрид Si3N4 и термически и химически стойкие бориды SiB3, SiB6 и SiB12. При температурах свыше 1000 °C можно получить соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд), который характеризуется высокой твёрдостью и низкой химической активностью. Карборунд широко используется как абразивный материал. При этом, что интересно, расплав кремния (1415 °C) может длительное время контактировать с углеродом в виде крупных кусков плотноспечённого мелкозернистого графита изостатического прессования, практически не растворяя и никак не взаимодействуя с последним. Нижележащие элементы 4-й группы (Ge, Sn, Pb) неограниченно растворимы в кремнии, как и большинство других металлов. При нагревании кремния с металлами могут образовываться силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магниятипа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах. Особо следует отметить, что с железом кремний образует эвтектическую смесь, что позволяет спекать (сплавлять) эти материалы для образования ферросилициевой керамики при температурах заметно меньших, чем температуры плавления железа и кремния. При восстановлении SiO2 кремнием при температурах свыше 1200 °C образуется оксид кремния (II) — SiO. Этот процесс постоянно наблюдается при производстве кристаллов кремния методами Чохральского, направленной кристаллизации, потому что в них используются контейнеры из диоксида кремния, как наименее загрязняющего кремний материала. Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены ещё два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др. Для травления кремния наиболее широко используют смесь плавиковой и азотной кислот. Некоторые специальные травители предусматривают добавку хромового ангидрида и иных веществ. При травлении кислотный травильный раствор быстро разогревается до температуры кипения, при этом скорость травления многократно возрастает. Si+2HNO3=SiO2+NO+NO2+H2O SiO2+4HF=SiF4+2H2O 3SiF4+3H2O=2H2SiF6+↓H2SiO3 Для травления кремния могут использоваться водные растворы щёлочей. Травление кремния в щелочных растворах начинается при температуре раствора более60C. Si+2KOH+H2O=K2SiO3+2H2↑ K2SiO3+2H2O↔H2SiO3+2KOH Применение Специально легированный кремний широко применяется как материал для изготовления полупроводниковых приборов (транзисторы, термисторы, силовые выпрямители тока, управляемые диоды – тиристоры; солнечные фотоэлементы, используемые в космических кораблях, и т. д.). Поскольку кремний прозрачен для лучей с длиной волны от 1 до 9 мкм, его применяют в инфракрасной оптике. Кремний имеет разнообразные и всё расширяющиеся области применения. В металлургии кремний используется для удаления растворённого в расплавленных металлах кислорода (раскисления).Кремний является составной частью большого числа сплавов железа и цветных металлов. Обычно кремний придаёт сплавам повышенную устойчивость к коррозии, улучшает их литейные свойства и повышает механическую прочность; однако при большем его содержании К. может вызвать хрупкость. Наибольшее значение имеют железные, медные и алюминиевые сплавы, содержащие кремний. Всё большее количество кремния идёт на синтез кремнийорганических соединений и силицидов. Кремнезём и многие силикаты (глины, полевые шпаты, слюды, тальки и т. д.) перерабатываются стекольной, цементной, керамической, электротехнической и др. отраслями промышленности.Силицирование, поверхностное или объёмное насыщение материала кремнием. Производится обработкой материала в парах кремния, образующихся при высокой температуре над кремниевой засыпкой, или в газовой среде, содержащей хлорсиланы, восстанавливающиеся водородом (например, по реакции SiCI4 + 2H2 = Si + 4HC1). Применяется преимущественно как средство защиты тугоплавких металлов (W, Mo, Ta, Ti и др.) от окисления. Стойкость к окислению обусловливается образованием при С. плотных диффузионных «самозалечивающихся» силицидных покрытий (WSi2, MoSi2 и др.). Широкое применение находит силицированный графит.Заключение Говоря о кремнии необходимо отметить большие количества его за-пасов на земле, он является основой земной коры и встречается в огромном многообразии силикатов, песка и т.д. В настоящее время использование кремния из-за его качеств полупроводника возрастает. Он используется в электронике при производстве компьютерных процессоров, микросхем и чипов. Соединения кремния с металлами образуют силициды, важнейшим кислородным соединением кремния есть оксид кремния SiO2 (кремнезем) В природе есть большое разнообразие силикатов - это тальк, асбест, также распространены алюмосиликаты. Список использованных источников 1 Большая советская энциклопедия. Третье издание. Т.28. - М.: Советская энциклопедия, 1970. 2 Краткая химическая энциклопедия. - М. "Советская энциклопедия", 1967. 3 Общая химия / Под ред. Е.М. Соколовской, Л.С. Гузея.3-е изд. - М.: Изд-во Моск. ун-та, 1989. 4 Мир неживой природы. - М., "Наука", 1983. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|