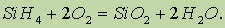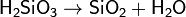|
|
Кислородные соединения кремнияКремний.Общая характеристика.Основное отличие от углерода:отсутствие п связи в соединениях.Силициды.Соединения с водородом(силаны),окисление и гидролиз.Тетрафторид и тетрахлорид кремния,гидролиз.Гексафторосиликаты.Кислородные соединения.Оксид кремния (IV).Силикагель.Кремневая кислота.Силикаты.Растворимость и гидролиз.Природные силикаты и алюмосиликаты,цеолиты.Кремнийорганические соединения.Силиконы и силоксаны.Использование в медицине соединений кремния. Кремний
Кремний (лат. Silicium), Si, химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28,086. Для кремния также характерна sp3-гибридизация электронных орбиталей. На внешнем электронном слое атома кремния есть валентные 3d- орбитали (Si: 3s23p23d0), Кремний после кислорода — самый распространенный элемент в земной коре. В отличие от углерода в свободном состоянии кремний в природе не встречается. Наиболее распространенными его соединениями являются оксид кремния (IV) SiO2 и соли кремниевых кислот — силикаты. Они образуют оболочку земной коры. Соединения кремния содержатся в организмах растений и животных. По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее, так как он имеет больший атомный радиус Кремний. образует соединения почти со всеми металлами - силициды (не обнаружены соединения только с Bi, Tl, Pb, Hg). Получено более 250 силицидов, состав которых (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si и др.) обычно не отвечает классическим валентностям. Силициды отличаются тугоплавкостью и твёрдостью; наибольшее практическое значение имеют ферросилиций (восстановитель при выплавке специальных сплавов, см. Ферросплавы) и силицид молибдена MoSi2 (нагреватели электропечей, лопатки газовых турбин и т. д.). Силан. При действии на силициды соляной кислоты получают простейшее водородное соединение кремния силан SiH4: Силан — ядовитый газ с неприятным запахом, самовоспламеняется на воздухе
Они реакционноспособны и являются сильными восстановителями, реагируют с водой при комнатной температуре: SiH4 + 2H2O → SiO2 + 4H2↑,: Тетрафторид кремния получают фторированием диоксида кремния элементным фтором. Процесс фторирования ведут в две стадии в пламенных реакторах, направляя избыток элементного фтора с 1-ой стадии на 2-ую. Техническим результатом является производство кремния в непрерывном режиме с высокими выходом и качеством продукции. Тетрафторид кремния SiF4 образуется при действии фтороводородной (плавиковой) кислоты на стекло: Na2SiO3 + 6HF ® 2NaF + SiF4 + 3H2O
Кислородные соединения кремния
Важнейшим кислородным соединением кремния является диоксид кремния SiO2 (кремнезем), имеющий несколько кристаллических модификаций. Низкотемпературная модификация (до 1143 К) называется кварцем. Кварц обладает пьезоэлектрическими свойствами. Природные разновидности кварца: горный хрусталь, топаз, аметист. Разновидностями кремнезема являются халцедон, опал, агат,. яшма, песок. [5, 322] Кремнезем химически стоек; на него действуют лишь фтор, плавиковая кислота и растворы щелочей. Он легко переходит в стеклообразное состояние (кварцевое стекло). Кварцевое стекло хрупко, химически и термически весьма стойко. Отвечающая SiO2 кремниевая кислота не имеет определенного состава. Обычно кремниевую кислоту записывают в виде xH2O-ySiO2. Выделены кремниевые кислоты: H2SiO3 (H2O-SiO2) - метакремниевая (три-оксокремниевая), H4Si04 (2H20-Si02) - ортокремниевая (тетра-оксокремниевая), H2Si2O5 (H2O * SiO2) - диметакремниевая. Кремниевые кислоты - плохо растворимые вещества. В соответствии с менее металлоидным характером кремния по сравнению с углеродом H2SiO3 как электролит слабее Н2СОз. [4,467 - 468] Отвечающие кремниевым кислотам соли-силикаты-в воде нерастворимы (кроме силикатов щелочных металлов). Растворимые силикаты гидролизуются по уравнению
2SiOз2-+H20=Si2O52-+20H-. Концентрированные растворы растворимых силикатов называют жидким стеклом. Обычное оконное стекло-силикат натрия и кальция-имеет состав Na20-CaO-6Si02. Его получают по реакции
Известно большое разнообразие силикатов (точнее, оксосиликатов). В строении оксосиликатов наблюдается определенная закономерность: все состоят из тетраэдров Si04, которые через атом кислорода соединены друг с другом. Наиболее распространенными сочетаниями тетраэдров являются (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), которые как структурные единицы могут объединяться в цепочки, ленты, сетки и каркасы (рис 4). Важнейшими природными силикатами являются, например, тальк (3MgO * H20-4Si02) и асбест (SmgO*H2O*SiO2). Как и для SiO2, для силикатов характерно стеклообразное (аморфное) состояние. При управляемой кристаллизации стекла можно получить мелкокристаллическое состояние (ситаллы). Ситаллы характеризуются повышенной прочностью. Кроме силикатов в природе широко распространены алюмосиликаты. Алюмосиликаты - каркасные оксосиликаты, в которых часть атомов кремния заменена на трехвалентный Аl; например Na12 [ (Si, Al) 04] 12. Для кремниевой кислоты характерно коллоидное состояние при воздействии на ее соли кислот H2SiO3 выпадает не сразу. Коллоидные растворы кремниевой кислоты (золи) при определенных условиях (например, при нагревании) можно перевести в прозрачную, однородную студнеобразную массу-гель кремниевой кислоты. Гели - высокомолекулярные соединения с пространственной, весьма рыхлой структурой, образованной молекулами Si02, пустоты которой заполнены молекулами H2O. При обезвоживании гелей кремниевой кислоты получают силикагель - пористый продукт, обладающий высокой адсорбционной способностью. Оксид кремния (IV) (кремнезем) — наиболее распространенное в земной коре соединение, составляющее в виде различных минералов 12% ее массы. Различают кристаллический и аморфный кремнезем. Простейшая формула оксида кремния (IV) — SiO2. Он кристаллизуется в атомной решетке. 1) Кристаллический кремнезем — в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма, кремень); кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности. 2) Аморфный кремнезем — в виде минерала опала состава SiO2•nН2О; землистыми формами аморфного кремнезема являются диатомит, трепел (инфузорная земля); примером искусственного аморфного безводного кремнезема может служить силикагель, который получают из метасиликата натрия: Na2SiO3+2HCl=2NaCl+H2SiO3 Силикагель имеет развитую поверхность, поэтому хорошо адсорбирует влагу. Силикаге́ль представляет собой высушенный гель, образующийся из перенасыщенных растворов кремниевых кислот (nSiO2·mH2O) при pH > 5—6. Твёрдый гидрофильный сорбент. Получение
Получается при подкислении растворов силикатов щелочных металлов с последующей промывкой и высушиванием образовавшегося геля:
Кремниевые кислоты. SiO2 является ангидридом ряда кремниевых кислот Кремниевая кислота построена из тетраэдрических структурных звеньев (в каждом таком звене атом кремния находится в центре тетраэдра, а по вершинам расположены атомы кислорода). Структурные звенья, объединяясь в цепи, образуют более устойчивые поликремниевые кислоты:
Состав такого соединения можно выразить формулой (H2SiO3)n. Однако обычно кремниевую кислоту изображают формулой H2SiO3. H2SiO3 — кислота очень слабая, в воде мало растворима. При нагревании легко распадается аналогично угольной кислоте:
Все кремниевые кислоты очень слабые (слабее угольной). Силикаты. Соли всех кремниевых кислот называют силикатами, хотя, как правило, в учебной литературе под силикатами подразумевают соли метакремниевой кислоты. Их состав обычно изображают формулой в виде соединений оксидов элементов. Например, силикат кальция CaSiO3 можно выразить так: СаО× SiO2.
Силикаты состава R2О× nSiO2, где R2O — оксиды натрия или калия, называются растворимым стеклом, а их концентрированные водные растворы — жидким стеклом. Наибольшее значение имеет натриевое растворимое стекло.
При стоянии на воздухе растворы силикатов мутнеют, так как находящийся в воздухе оксид углерода (IV) вытесняет кремниевую кислоту из ее солей:
Кремниевая кислота практически нерастворима в воде — это свойство используют как качественную реакцию на ион SiO32- .
Силикаты получают сплавлением оксида кремния с щелочами или карбонатами:
Растворимость кремневой кислоты и скорость ее растворения зависят от нескольких факторов, из которых важнейшие — взятая модификация двуокиси кремния, степень ее дисперсности и температура. При встряхивании с водой геля кремневой кислоты равновесие растворимости устанавливается за несколько часов, в случае кварца нужны многие месяцы и даже годы. СИЛИКАТЫ ПРИРОДНЫЕ (от лат. silex, род. падеж silicis — кремень * а. natural silicates; н. naturliche Silikate; ф. silicates naturels; и. silicatos naturales) — класс минералов, солей кремниевой, изо- и гетерополикремниевых кислот. На долю силикатов природных приходится до 75% массы земной коры и около 25% минеральных видов. В природе известно свыше 700 силикатов природных, включая важнейшие породообразующие минералы (полевые шпаты, пироксены, амфиболы, слюды и др.) Алюмосиликаты — группа природных и синтетических силикатов, комплексные анионы которых содержат кремний и алюминий. Примеры комплексных анионов: [AlSiO4]−, [AlSi4O10]−, [Al2Si3O10]2−. В качестве катионов выступают Na+, K+, Mg2+, Ca2+, а иногда Ba2+ и Li+.
Природные алюмосиликаты являются наиболее распространёнными минералами, на их долю приходится до 50 % массы земной коры. К ним относятся полевые шпаты (альбит, ортоклаз, анортит), глинистые минералы и слюды. Цеолиты — это водные алюмосиликаты кальция, натрия, калия, бария и некоторых других элементов. В группу цеолитов входит более сорока минералов, которые различаются и по составу (в особенности по количеству молекул воды в кристаллогидрате), и конечно же по физическим и химическим свойствам. Но практически у всех представителей этой группы минералов есть общее свойство — они хорошие сорбенты, обладают ионообменными свойствами, способны изменять подвижность отдельных ионов и работать молекулярными ситами. А сравнительно недавно эти минералы нашли совершенно неожиданное применение — их стали использовать в сельском хозяйстве.
Кремнийорганические соединения — соединения, в молекулах которых имеется связь между атомами кремния и углерода. Кремнийорганические соединения иногда называют силиконами, от латинского названия кремния «силициум». Кремнийорганические соединения используются для производства смазок, полимеров, резин, каучуков, кремнийорганических жидкостей и эмульсий. Кремнийорганические соединения применяются в косметике, бытовой химии, лакокрасочных материалах, моющих средствах. Отличительной особенностью продукции на основе кремнийорганических соединений от продукции на основе обычных органических соединений являются, как правило, более высокие эксплуатационные качества и характеристики, а также безопасность применения человеком. Кремнийорганические полимеры могут использоваться для изготовления форм в кулинарии. Полимеризация кремнийорганических компаундов и герметиков безопасна для человека и не требует вытяжки. СИЛОКСАНЫ - соединения, содержащие в молекуле чередующиеся атомы кремния и кислорода. Наибольшее имеют высокомолекулярные силоксаны - полиорганосилоксаны; см. Кремнийорганические полимеры. Силико́ны (полиорганосилоксаны) — кислородосодержащие высокомолекулярные кремнийорганические соединения с химической формулой [R2SiO]n, где R = органическая группа (метильная, этильная или фенильная). Сейчас этого определения придерживаются уже крайне редко, и в «силиконы» объединяются также полиорганосилоксаны (например силиконовые масла типа ПМС, гидрофобизаторы типа ГКЖ или низкомолекулярные каучуки типа СКТН) и даже кремнийорганические мономеры (различные силаны), стирая различия между понятиями «силиконы» и «кремнийорганика».

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|