|
|
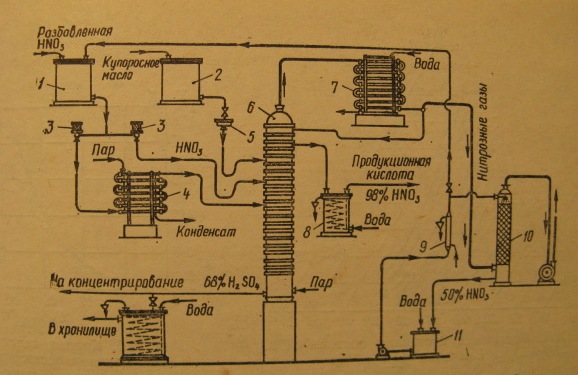
Способы получения концентрированной азотной кислоты. Технологическая схема получения концентрированной азотной кислоты методом выпарки с водоотнимающимисредствами.Способы получения концентрированной азотной кислоты: 1 Методом выпарки 2 Методом прямого синтеза Дисцилляция разбавленных водных растворов азотной кислоты позволяет концентрировать ее до содержания 60 – 65%
Разбавленная 31 Прямой синтез конц. HNO3 из оксида азота 3NO2+H2O=2HNO3+NO; 2NO+O2=2NO2 Т.к. реакция обратима, то lim стадия является окисление. Следовательно, надо мах увеличить конц. NO2 и создать условия, чтобы υ окисления была большой. Конц. оксидов азота в нитрозном газе ≤11%. Для получения конц. HNO3, надо использовать чистый оксид азота и окисление вести при Р=4-5 Мпа. N2O4+H2O+0,5O2=2HNO3 для осуществления этой реакции необходимо получить 100% N2O2. 4NH3+5O2=4NO+6H2O (Т=800-9000С, kat), конц NO =10-11% 4NO+O2=4NO2 3NO2+2H2O+О2=4HNO3 4NH3+5O2=4HNO3+4H2O Этим способам можно получить 77,7% HNO3, для получения 100% необходимо удалить 4 моля воды из реакции. Следовательно, нужно полное окисление NO до NO2 с последующей конденсацией NO2, при Т=240С NO2 переходит в N2O4. Конденсацию ведут так, чтобы υ окисления NO до NO2 была миn. Этого можно достичь при резком охлаждении. Окисление NO до NO2 ведут в две стадии(т.к. 100% окисления О2 достичь невозможно): 1) Кислородом окисляют NO 2) Конц. HNO3 (С=75%) доокисляют оставшийся NO Для конденсации NO2 увеличивают Р(от 3,3 до 10 атм, дальнейшее увеличение Р экономически не выгодно), Т=-100С(Тзам.=-100С). Для облегчения конденсации используют 100% NO2. 100% NO2 получают абсорбцией нитрозных газов. Абсорбцию NO2 ведут 100% HNO3, при десорбции получают 100% NO2. nNO2+ HNO3= HNO3*nNO2+Q (получение нитроолеума). Растворимость NO2 в 100% HNO3 зависит от конц. HNO3, Т и содержания NO2 в нитрозном газе(10-11%). Растворимость NO2 в 100% HNO3 составляет 30%, остаточное содержание NO2 0,1-0,2% в газе. Для выделения NO2 в газовую фазу, нитроолеум нагревают до Т=Ткип.100% HNO3 (850С). Конденсацию ведут в рассольных холодильниках до Т=-100С 2NO2 =N2O4.(получили 100% N2O4 из нитрозных газов). N2O4+H2O+0,5 O2=2HNO3+Q. N2O4+H2O=HNO3+HNO2 3HNO2= H2O+2NO+2HNO3 2NO+O2=2NO2-lim стадия Чтобы увеличить скорость lim процесса, нужно использовать для окисления чистый О2, увеличить Р(4-5 Мпа), при этих условиях lim стадией становится разложение HNO2. А для увеличения скорости этой реакции необходимо увеличить Т до 70-800С. Для получения 100% HNO3 надо оптимальное соотношение N2O4 и H2O. На практике используют небольшой избыток N2O4 и получают нитроолеум, который потом подвергают отбелке(т.е. отгоняют свободный N2O4).
Виды Азотных Удобрений Азотные удобрения играют важную роль в решении задач повышения урожайности сельскохозяйственных культур, обеспечения страны продовольствием, а также получения валютных поступлений за счет их поставки. Ассортиментный состав выпуска азотных удобрений насчитывает более 20 различных видов и марок удобрений. Выпускаются как одинарные азотные удобрения, так и сложные. Одинарные азотные удобрения производятся следующие: карбамид, аммиачная и калиевая селитры, сульфат аммония, аммиак для сельского хозяйства, аммиачная вода, КАС (карбамид-аммиачная селитра). ОАО «Гродно Азот» является единственным в Республике Беларусь производителем одинарных азотных удобрений. Кроме этого ОАО «Гродно Азот» специализируется на выпуске метанола и капролактама. Мощности предприятия по выпуску основных видов продукции следующие: 1) Аммиак жидкий технический - 900 тыс. т в год; 2) Карбамид - 1000 тыс. т в год; 3) Удобрения жидкие азотные (КАС) - 720 тыс. т в год; 4) Метанол технический - 66 тыс. т в год; 5) Капролактам - 111,2 тыс. т в год; 6) Сульфат аммония - 319 тыс. т в год; 7) Гидроксиламинсульфат кристаллический - 3,3 тыс. т в год. Сульфат аммония производится из отходов производства капролактама.Основной реакцией получения сульфата аммония является нейтрализация аммиака серной кислотой.Эта реакция протекает с выделением тепла. Сам по себе сульфат аммония представляет собой белое криссталическое вещество, почти не гигроскопичное, не слеживаемое. Но есть один большой недостаток, из-за которого его применение ограничено: процентное содержание азота в нем невелико, всего лишь 21 %. Содержание свободной серной кислоты = 30 %. Кристаллизация сульфата аммония идет при Т = Ткрис , т.е при 108,5 С. Сушка протекает в 2 стадии (горячяя и холодная). Сам процесс образования сульфата аммония можно описать следующим образом: Раствор слабо концетрированный 10 % → Выпарка → Сгущение → Центрифугирование → Сушка. После центрифуги влажность сульфата достигает 2,5 %, а после сушки всего лишь 0,2 %. Аммиачная селитра является одним из основных и самых востребованных агорохозяйствами азотных минеральных удобрений. Аммиачная селитра NH4N03 содержит 34-35% азота. В нём удачно сочетается быстродействующий нитратный азот с менее подвижным аммиачным. Хорошо растворяется в воде. Это безбалластное удобрение, и стоимость перевозки содержащегося в нём азота ниже, чем при перевозке других азотных удобрений (за исключением карбамида и жидкого аммиака). Кристаллический продукт при хранении слёживается. Поэтому значительную часть этого удобрения промышленность выпускает в гранулированном виде. Аммиачную селитру применяют в качестве основного удобрения при посеве (в лунки, гнёзда, лентой) и в виде подкормки. Только на песчаных и суперпесчаных почвах возможно частичное вымывание азота, внесённого заранее. Поэтому здесь не следует вносить это удобрение осенью. Основной метод: Было отмечено,что в промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Метод Габера: из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония: 3H2 + N2 → 2 NH3 (При давлении, высокой температуре и катализаторе); NH3 + 2O2 → HNO3 + H2O; HNO3 + NH3 → NH4NO3. Нитрофосфатный метод: Этот способ так же известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс). Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы: Природный фосфат кальция (апатит) растворяют в азотной кислоте: Ca3(PO4)2 + 6HNO3 + 12H2O → 2H3PO4 + 3Ca(NO3)2 + 12H2O. Полученную смесь охлаждают до 0°С, при этом нитрат кальция кристаллизуется в виде тетрагидрата — Ca(NO3)2·4H2O, и его отделяют от фосфорной кислоты. На полученный нитрат кальция и не удалённую фосфорную кислоту действуют аммиаком, и в итоге получают нитрат аммония: Ca(NO3)2 + 4H3PO4 + 8NH3 → CaHPO4↓ + 2NH4NO3 + 3(NH4)2HPO4. NН3 Химическая формула – NН3. Относительная молекулярная масса – 17. Продуктом производства является синтетический аммиак. Жидкий аммиак (NН3) – бесцветная прозрачная жидкость с резким запахом, образуется в результате охлаждения газообразного аммиака до минус 33,4°С при атмосферном давлении. При температуре минус 78°С затвердевает в виде кристаллов кубической формы. Плотность жидкого аммиака равна 681,4 кг/м3. Критическая температура аммиака равна 132,4°С, критическое давление 115 кгс/см2. Молярная теплоемкость аммиака при атмосферном давлении и 20°С равна 35,66 кДж/моль·град, молярная теплота испарения при минус 33,4°С составляет 22,37 кДж/моль. Карбамид Карбамид представляет собой бесцветные кристаллы легко растворимые в воде, спирте, жидком аммиаке, сернистом ангидриде. Температура плавления 132,7°C, плотность 1,33•103 кг/м3. Карбамид при нормальных условиях пожаро- и взрывобезопасен, не токсичен. Карбамид упаковывают в клапанные бумажные и полимерные мешки по нормативно-технической документации. Навалом в железнодорожные вагоны типа «хоппер», минераловозы, а также в специализированные металлические контейнеры. Для розничной торговли продукт упаковывают в полиэтиленовые пакеты, массой не более 3 кг. Хранят в закрытых сухих складских помещениях. Контейнеры с карбамидом и транспортные пакеты допускается хранить на открытых площадках. Транспортируют в упакованном виде и насыпью всеми видами крытого транспорта, кроме воздушного. КАС Для производства КАС используется раствор карбамида, вырабатываемый цехом карбамид объединенный, и плав аммиачной селитры, вырабатываемый цехом слабой азотной кислоты и жидких азотных удобрений. Для производства плава аммиачной селитры и раствора карбамида исходным сырьем является аммиак. Исходным сырьем для производства капролактама являются: бензол, аммиак, водород, гидроксиламинсульфат (ГАС), олеум (серная кислота) и сода каустическая. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 . Только введением в разбавленную
. Только введением в разбавленную