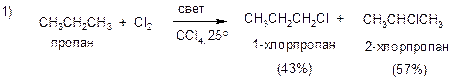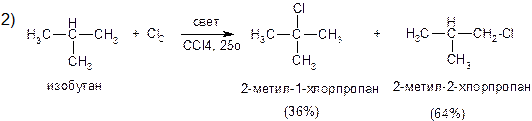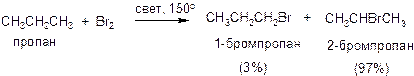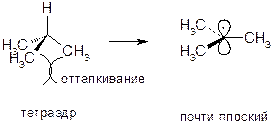|
|
Избирательность реакций хлорирования и бромирования12
При монозамещении в метане и этане может образоваться только по одному продукту (СН3Cl и С2Н5Cl). Начиная с пропана, в молекулах алканов, как правило, имеется несколько типов связей С-Н, поэтому замещение может приводить к образованию нескольких изомеров. Примеры:
Таким образом, реакция хлорирования алканов неизбирательна. Бромирование алканов – гораздо более избирательный процесс. Пример:
Селективность реакции характеризуется относительными скоростями замещения.
Расчет относительных скоростей замещения у первичного, вторичного и третичного атомов углерода по соотношению изомерных продуктов монозамещения (на примере реакции хлорирования)
1) Хлорирование пропана. В пропане имеется шесть равноценных связей Сперв-Н и две равноценные связи Свтор-Н, и относительные скорости замещения у вторичного и у первичного атомов углерода могут быть выражены: V втор : Vперв = (57/2) : (43/6) = 4 : 1. 2) Хлорирование изобутана. Аналогично, из данных по выходу продуктов монохлорирования изобутана относительные скорости замещения у третичного и у первичного атомов углерода могут быть выражены: V трет : Vперв = (36/1) : (64/9) = 5 : 1.
Селективность хлорирования и бромирования алканов:
Приведенные в таблице данные по относительным скоростям хлорирования и бромирования алканов не являются величинами постоянными (их численные значения относительных скоростей хлорирования зависят как от природы алкана, так и сильно – и условий проведения реакции). Однако всегда соблюдается закономерность:
Относительная стабильность алкильных радикалов: третичный > вторичный > первичный Относительную стабильность алкильных радикалов определяют экспериментально по энергиям разрыва связи С-Н.
Энергии гомолитической диссоциации некоторых алканов R-H ® R× + H× + ΔH:
Относительную стабильность алкильных радикалов обычно связывают с совместным действием двух эффектов: гиперконьюгации и пространственного (стерического). 1) Эффект гиперконьюгации (взаимодействие р-орбитали радикального центра со связями С-Н, образованными sp3-гибридными орбиталями, в b-положениях. Например, для этильного радикала:
В результате происходит делокализация неспаренного электрона. Делокализация электронной плотности всегда повышает устойчивость частицы. Чем больше b-связей С-Н, тем больше делокализация. 2) Пространственный фактор. Свободные алкильные радикалы являются почти плоскими частицами, в которых неспаренный электрон занимает почти негибридизованную 2р-орбиталь. Следовательно, пространственное отталкивание между заместителями у радикального центра будет ослабляться при переходе от алкана к алкильному радикалу, и в ряду свободных радикалов ×СН3 , СН3СН2×, (СН3)2СН×, (СН3)3С× это ослабление наиболее значительно для трет-бутильного радикала:
РЕАКЦИИ ОКИСЛЕНИЯ алканов Под действием кислорода воздуха алканы подвергаются окислению, который также протекает по гомолитическому механизму – так называемое пероксидное окисление (см. раздел «Пероксидное окисление алкенов»).

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|