
|
|
Способы выражения концентрации стандартных растворов.12 КУРСОВАЯ РАБОТА Тема 1. Титрование 0.2 М CН3СООН раствором 0.2 М NaOH. Тема 2. Титрование ионов Mg2+ 0.1 М раствором ЭДТА.
Уфа-2013
Содержание 1.Общее положение титриметрии. 3 1.1.Сущность титриметрии. 3 1.2.Стандартные растворы. 5 1.3.Способы выражения концентрации стандартных растворов. 6 1.4.Кривые титрования. 6 2.Кислотно-основное титрование. 11 2.1.Кривые титрования. 12 2.2.Титрование слабой кислоты сильной щелочью. 12 2.2.1.Титрование CH3COOH раствором NaOH. 12 2.3.Факторы, влияющие на скачок титрования. 16 2.4.Способы обнаружения точки эквивалентности. 16 2.5.Погрешности титрования. 20 2.6.Вычисление индикаторной погрешности титрования: 21 2.7.Вывод по кривой титрования. 22 3.Комплексонометрия. 22 3.1. Титрование ионов Mg2+ 0,1 М раствором ЭДТА. 23 3.2.Выбор индикатора. 27 3.3. Выводы по кривой титрования. 29 Список литературы.. 30
Общее положение титриметрии Сущность титриметрии Вещества реагируют между собой в эквивалентных количествах (n1=n2). Так как n=cV*10-3, где c- молярная концентрация эквивалента, а V - объём, в котором растворено вещество, то для двух стехиометрически реагирующих веществ справедливо соотношение: c1V1=c2V2. Следовательно, можно найти неизвестную концентрацию одного из веществ (пусть c2), если известны объём его раствора, объём и концентрация прореагировавшего с ним вещества. Зная молекулярную массу эквивалента М, находят массу вещества: m2=c2MV0*10-3 (1) Чтобы зафиксировать конец реакции, который называют точкой стехиометричности, или точкой эквивалентности (ТЭ), раствор с известной концентрацией вещества (его называют титрантом, Т) постепенно, небольшими порциями, добавляют к раствору определяемого вещества А. Этот процесс называется титрованием. После добавления каждой порции титранта в растворе устанавливается равновесие реакции титрования аА + tT Реакция титрования должна отвечать следующим требованиям: 1) быть строго стехиометричной; 2) протекать быстро; 3) протекать количественно, поэтому константа равновесия должна быть высокой; 4) должен существовать способ фиксирования точки эквивалентности. Экспериментально конец титрования устанавливают по изменению цвета индикатора или какого-либо физико-химического свойства раствора. Эта точка, называемая конечной точкой титрования (КТТ), в общем случае не совпадает с теоретически рассчитанной точкой эквивалентности. По способу выполнения различают прямое, обратное титрование и титрование заместителя. При прямом титровании титрант непосредственно добавляют к титруемому веществу. Такой способ применим только при выполнении всех требований, перечисленных выше. Если скорость реакции мала, или не удается подобрать индикатор, или наблюдаются побочные эффекты, например потери определяемого вещества вследствие летучести, можно использовать приём обратного титрования: добавить к определяемому веществу заведомый избыток титранта Т1, довести реакцию до конца, а затем найти количество непрореагировавшего титранта его другим реагентом Т2 с концентрацией с2.Очевидно, что определяемое вещество затрачивается количество титранта Т1, равное разности cTVT-cTVT. Если реакция нестехиометрична или протекает медленно, можно использовать титрование заместителя. Для этого проводят стехиометрическую реакцию определяемого вещества с вспомогательным реагентом, а получающийся в эквивалентном количестве продукт оттитровывают подходящим титрантом. Обычно при титриметрическом определении проводят несколько параллельных титрований. При этом возможны два варианта: метод пипетирования и метод отдельных навесок. Метод пипетирования заключается в титровании равных порций раствора (аликвот Vx), отбираемых пипеткой из мерной колбы определённого объёма V0, в которой растворена навеска анализируемого вещества. Массу определяемого вещества mA вычисляют по уравнению (1), подставляя в него среднее арифметическое из результатов параллельных титрований VT. при этом учитывают молекулярную массу эквивалента определяемого вещества МА и вводят коэффициент 10-3, поскольку все объёмы выражают в миллилитрах, а концентрация титранта сТ выражена в молях эквивалентов в литре: -для прямого титрования -для обратного титрования
-Для нахождения процентного содержания следует учесть массу навески m:
Метод отдельных навесок заключается в том, что n навесок вещества (m1,m2 и т.д.), взятых на аналитических весах, растворяют в небольших объёмах растворителя (знать их нет необходимости) и проводят титрование в каждом растворе. В этом случае количество вещества в каждой навеске равно cTVT миллимоль и
Метод пипетирования более экспрессен и менее трудоёмок, но и менее точен, чем метод отдельных навесок. Стандартные растворы. Для титриметрического определения необходимо знать концентрацию титранта. Титрант с известной концентрацией называют стандартным раствором. По способу приготовления различают первичные и вторичные стандартные растворы. Первичный стандартный раствор готовят растворением точного количества чистого химического вещества известного стехиометрического состава в определенном объёме растворителя. Вторичный стандартный раствор получают следующим образом: готовят раствор с приблизительной концентрацией, близкой к желаемой, и определяют его концентрацию (стандартизируют) по подходящему первичному стандартному раствору. Первичный стандартный раствор должен отвечать ряду требований: 1. Состав соединения должен строго соответствовать химической формуле. Содержание примесей не должно превышать 0,05%, что примерно соответствует относительному стандартному отклонению при изменении массы навески. 2. Вещество должно быть устойчивым при комнатной температуре; вещества гигроскопичные или легко окисляющиеся атмосферным кислородом или поглощающие диоксид углерода непригодны. Первичное стандартное вещество должно быть по возможности безводным и нелетучим. 3. Вещество должно обладать по возможности большой молекулярной массой, чтобы уменьшить влияние неизбежной погрешности взвешивания. Для приготовления многих стандартных растворов можно воспользоваться фиксаналами. Фиксанал представляет собой ампулу, в которой запаяно точно известное количество стандартного вещества или раствора. Для приготовления раствора известной концентрации нужно разбить ампулу над специальной воронкой с пробивным устройством, перенести содержимое ампулы в мерную колбу подходящего объёма и разбавить водой до метки. Способы выражения концентрации стандартных растворов. Обычно концентрацию растворов выражают в молях эквивалентов вещества в 1 л раствора (молярная концентрация эквивалента). Иногда используют также титр по исходному веществу: это количество граммов стандартного вещества в 1 мл раствора. При проведении однотипных титриметрических определений удобен титр по определяемому веществу - масса определяемого вещества, с которой реагирует 1 мл стандартного раствора. Например, Кривые титрования. В процессе титрования изменяются равновесные концентрации вещества, титранта и продуктов реакции. При этом пропорционально концентрациям этих веществ изменяются свойства раствора. Например, при окислительно-восстановительном титровании изменяются равновесные концентрации окислителя и восстановителя и, следовательно, потенциал; при изменении концентраций компонентов кислотно-основной реакции изменяется pH раствора. График зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта, от состава раствора в процессе титрования называют кривой титрования. Кривые титрования помогают выбрать индикатор, оценить погрешность, наглядно проследить за ходом титрования. При построении кривых титрования по осям координат можно откладывать разные величины. Если по оси ординат отложить логарифм концентрации (или отношения концентраций) или величину, пропорциональную этому логарифму, получаются логарифмические кривые титрования. Если же по оси ординат откладывать концентрацию или физико-химический параметр, пропорциональный концентрации, получают линейные кривые титрования. По оси абсцисс обычно откладывают объём добавленного титранта VT или степень оттитрованности f, т.е. отношение количества оттитрованного в данный момент вещества nT к исходному количеству n0. Поскольку cTVT = nT и n0= c0V0 = cTVTЭ, получаем
а при c0 = cT
где VT - объём титранта, добавленный к данному моменту титрования; V0 - исходный объём титруемого вещества; VTЭ - объём титранта, добавленный моменту эквивалентности; c0 и cT - молярные концентрации эквивалентов (или нормальные концентрации) титруемого вещества и титранта. Степень оттитрованности иногда выражается в процентах. Очевидно, что до ТЭ f<1(<100%), за ТЭ f>1(>100%), в ТЭ f=1(100%). В некоторых случаях продукты реакции титрования практически не влияют на равновесные концентрации [A] или [T]. Например, при титровании сильной кислоты сильным основанием, при осадительном титровании, при комплексонометрическом титровании продуктов (H2O, малорастворимое соединение или комплекс) практически выводятся из реакции. В этих случаях при построении кривых титрования по оси ординат можно отложить логарифм концентрации А (или Т). Такие кривые называются монологарифмическими. Если же продукты реакции каким-то образом влияют на [A] или [T], то при расчете [A] следует учитывать равновесные концентрации продуктов. Например, при титровании слабых кислот (или оснований) и окислительно-восстановительном титровании получаются сопряжённые вещества: при титровании слабой кислоты - сопряжённое основание, при титровании окислителя - его восстановленная форма. Переменный параметр (pH или E) будет определяться отношением концентраций сопряжённой пары. Кривые, по оси ординат которых отложен логарифм отношения концентраций (или пропорциональная ему величина), называют обычно билогарифмическими. Монологарифмические кривые. В любой момент титрования до ТЭ концентрацию титруемого вещества можно представить так:
Концентрация титранта в растворе до ТЭ ничтожна мала, поскольку при высоком значении константы реакции (а это одно из условий титрования) титрант практически весь тратится на взаимодействии с А. За ТЭ концентрация А ничтожна мала, поэтому за ходом титрования следят по изменению равновесной концентрации титранта
Формулы и можно упростить. 1.если концентрация титранта значительно выше концентрации определяемого вещества, то множитель V0/(V0+VT) мало отличается от единицы и выражения (4) и (5) упрощаются до [A] = c0(1-f), (6) [T] = cT(f-1), (7) или в логарифмической форме lg[A] = lg c0+lg(1-f), (8) lg[T] = lg cT +lg(f-1), (9) 2. если c0 ≈cT, то
3. Если c0 ≈cT и при этом пренебрегают изменением объёма при титровании, то получают формулы (6)-(7). За ТЭ можно выразить [A] через [T], воспользовавшись для этого константой реакции титрования KT. Для кислотно-основных реакций
для реакции осаждения KT = [A][B] =Ks
для реакции комплексообразования
поскольку за ТЭ [ML] ≈с0. В ТЭ рассчитываемый параметр определяется только константой реакции титрования, например для кислотно-основных реакций
для реакции осаждения
для комплексообразования
Билогарифмические кривые. Выражая отношение концентраций компонентов сопряжённой пары через известные величины, получаем до ТЭ:
Для определения параметра, меняющегося при титровании, пользуются константой соответствующей реакции. Например, в кислотно-основном титровании это константы кислотности Ka или основности Kb
За ТЭ ветви кривых представляют собой монологарифмические кривые. При рассмотрении конкретных методов титрования мы остановимся на вычислении соответствующих параметров за ТЭ и в ТЭ. Логарифмические кривые имеют S-образную форму. На кривых имеются области плавного (до и после ТЭ) и резкого (вблизи ТЭ) изменения рассчитываемого (или измеряемого) параметра. Область резкого изменения называют скачком титрования. Границы скачка устанавливаются в зависимости от заданной точности титрования. Чем выше требования к точности определения, тем уже скачок титрования. На величину скачка влияет ряд факторов: константа равновесия реакции, концентрация веществ, температура, ионная сила и т.д. При визуальном обнаружении ТЭ пользуются индикаторами. Это вещества, окраска которых изменяется при определённом значении параметра. Индикатор выбирают так, чтобы его окраска изменялась в пределах установленного скачка титрования (необязательно в ТЭ). При этом точка изменения окраски индикатора (конечная точка титрования ,КТТ) не совпадает с ТЭ, что вызывает погрешность титрования (положительную, если титрование заканчивается после достижения ТЭ, и отрицательную, если раньше). Очевидно, что для правильного выбора индикатора и оценки погрешности титрования необходимо построение кривой титрования. Кривую титрования можно охарактеризовать крутизной, которая является мерой чувствительности и точности титрования:
Если переменный параметр измеряют, а не рассчитывают (например, pH на pH-метре при кислотно-основном титровании или потенциал при окислительно-восстановительном титровании), то получаются экспериментальные кривые. Линейные кривые строят, откладывая по оси ординат свойство системы, прямо пропорциональное концентрации определяемого вещества, титранта, продукта реакции или их комбинации. Таким свойством может быть электродный потенциал, светопоглощение, электрическая проводимость и т.д. Для реакции титрования A + T = Q1 +Q2 +… свойство (обозначим его y) определяется всеми составляющими:
где k - коэффициент пропорциональности. Если
Линейные кривые обычно получают экспериментально при фотометрическом, кондуктометрическом, термометрическом и радиометрическом титровании. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 продукты.
продукты.

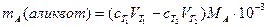 .
.
 .
. = 0,008 г/мл означает, что 1 мл раствора HCl реагирует с 0,008 г CaCO3.
= 0,008 г/мл означает, что 1 мл раствора HCl реагирует с 0,008 г CaCO3.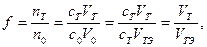 (2)
(2) (3)
(3)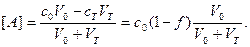 (4)
(4) (5)
(5)

 (10)
(10)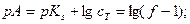 (11)
(11)

 (12)
(12) , (13)
, (13) , (14)
, (14)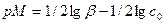 . (15)
. (15)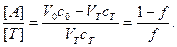 (16)
(16) (17)
(17) (18)
(18) (19)
(19) ,
, равны нулю, то у зависит только от [A]:
равны нулю, то у зависит только от [A]: