|
|
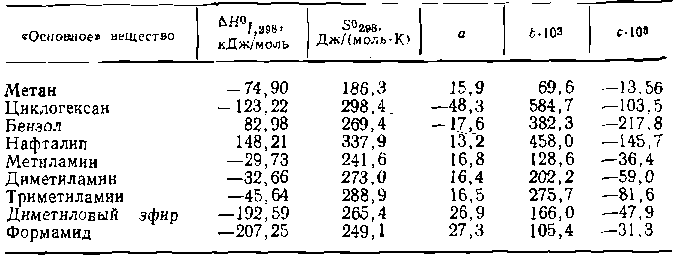
ПРИБЛИЖЕННЫЕ МЕТОДЫ РАСЧЕТА КОНСТАНТ РАВНОВЕСИЯДля расчета термодинамических характеристик химических реакций по способам, изложенным в предыдущем разделе, нужно знать ряд величин, определяемых экспериментально. В некоторых случаях одно (или несколько) из необходимых исходных данных в литературе отсутствует; в этом случае приходится прибегать к менее точным методам расчета ∆G0 и Кр.Наибольшее распространение при практических расчетах находит так называемый метод структурных групп, который позволяет приближенно рассчитывать термодинамические данные. Для органических веществ многих типов стандартные теплота образования ∆H°f,298 и энтропия S°298, а также коэффициенты а, bи св уравнении теплоемкости можно подсчитать по правилу аддитивности, учитывая число атомов углерода в молекуле, характер связей и тип функциональных групп. Исходными данными для таких расчетов служат термодинамические функции девяти «основных» веществ, представленные в табл. 3.
Молекула соединения, для которого проводится расчету должна быть построена исходя из соответствующего «основного» вещества, причем в первую очередь путем постепенного замещения атомов водорода метильными группами строится углеродный скелет. Введение в молекулу функциональных групп, (если оно необходимо) проводится путем замены не водорода, а заранее введенной метильной группы. При этом функциональная группа замещает столько метильных, какова кратность ее связи с атомом углерода; например, для введения одной карбонильной группы нужно заместить сразу две метильные группы. Это обстоятельство следует учитывать при построении углеродного скелета молекулы. В ходе построения углеродного скелета молекулы вещества, для которого проводится расчет, каждое замещение водорода метильной группой, как и введение функциональной группы, приводит к изменению величин ∆Н°/,298, S°298, а, Ь и сна некоторые поправки. Величина поправки зависит от типа замещения и природы функциональной группы. Первое замещение водорода в молекуле «основного» вещества называется первичным; таким же считается и расширение кольца в молекуле циклогексана. Для бензола и нафталина все последовательные замещения в ядре — первичные, однако поправки зависят от относительного расположения заместителей (табл. 4). Все остальные замещения водорода называются вторичными; для них величина поправки зависит от структуры молекулы, в которой проводится; замещение (табл. 5). Структурные особенности молекулы определяются ее строением, причем учитывают тип атома, у которого происходит замещение (тип А), и тип (соседнего, наиболее замещенного атома углерода (тип В). Типы А н В обозначают цифрами от 1 до 4, соответствующими степени замещенности данного атома — первичного, вторичного, третичного или четвертичного. Тип атома, находящегося в ароматическом кольце, обозначают цифрой 5. В соответствии с этим, например, поправки к теплотам образования при переходе от пропана к изо- бутану (А = 2, В = 1) и от этилбензола к изопропилбензолу
(А = 2, В = 5) неодинаковы и составляют соответственно -—26,42 и —25,87 кДж/моль. Наличие в молекуле искомого вещества кратных связей тоже учитывают при расчете путем введения соответствующих поправок; в этом случае поправки определяются типами А и В Таблица 5. Поправки на вторичное замещение H на СH3
двух атомов, между которыми возникает кратная связь (табл. 6). На этом этапе расчета учитывают и появление сопряженных связей, вносящее свой вклад в изменение термодинамических характеристик. Например, при превращении изобутана в изобутен (А=1, В —3) поправка к теплоте образования равна 118 кДж/моль, а при переходе (того же типа) от изопро-
лилбензола к а-метилстиролу кроме этой появляется еще по- правка на сопряжение с ароматическим кольцом, равная —8,37 кДж/моль. Последним- этапом расчета является учет поправок при замещении групп СН3 на соответствующие функциональные группы (табл. 7). Окончательный результат расчета — термодинамические характеристики вещества — находят, суммируя соответствующие ‘свойства исходного «основного» вещества и все поправки, по- ■явившиеся при построении углеродного скелета молекулы, введении функциональных групп и кратных связей.
По методу структурных групп не обязательно начинать расчет с «основных» веществ, так как более надежные результаты .получаются исходя нз веществ более близкого строения, если для них имеются термодинамические данные. Метод структурных групп предполагает, собственно, что для однотипных реакций ∆H°, S0и коэффициенты а, bи св уравнениях теплоемкости равны друг другу. Более обоснованно предпо ложение, что для двух однотипных реакций (I и II) равны только ∆S0. Это позволяет находить константу равновесия, если известны константа равновесия какой-либо однотипной реакции и их тепловые эффекты. Действительно, из ∆Si°=∆Si° следует;
Откуда
и, следовательно:
Этот способ (метод В. А. Киреева) более точен, чем метод структурных групп. Другие видоизменения последнего основаны на различных корреляционных зависимостях в рядах органических соединений при их участии в однотипных реакциях. Все они требуют определенного минимума экспериментальных данных и подробно излагаются в специальной литературе. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|