
|
|
РАСЧЕТ МАТЕРИАЛЬНОГО БАЛАНСА12
Дня расчета материального баланса должны быть заданы исходные данные: В1 - производительность либо по массе сжигаемого колчедана в т/год, либо по массе продукта из рекуперационной серы (серной кислоты какой-либо заданной концентрации или олеума), т/год, α - массовая доля использования серы, %; С Сsсух.колч. - массовая доля серы в сжигаемом колчедане на сухую массу, %; Сsогар. - массовая доля серы в огарке, %; C tвозд. - температура воздуха, подаваемого на сжигание, °С; tколч. - температура колчедана, подаваемого на сжигание, °С; φ - относительная влажность воздуха, об.д., %; tоб.газ.- температура обжигового газа на выходе из печи, °С; tогар. - температура огарка на выходе из печи, °С. Сера в колчедане содержится в виде пирита. Уравнение для процессов горения FeS2 до SО2 и суммарное уравнение превращения FeS2 в SO3:
4FeS2 + 11О2 = 2Fe2O3 + 8SO2 (2.1) 4∙120 11·32 2·160 8·64
4FeS2 + 15O2 = 2Fe2O3 + 8SO3 (2.2) 4·120 15·32 2·160 8·80
Вначале рассчитывается масса серы Gsпрод. в серной кислоте или олеуме а) в разбавленной серной кислоте: Gsпрод. = б) в олеуме Gsпрод. = где
32 - относительная атомная масса серы; 98 - относительная молекулярная масса серной кислоты; 80 - относительная молекулярная масса SO3. Масса серы в перерабатываемом колчедане определяется с учетом степени, использования серы: Gsколч. =
Далее рассчитывается расход колчедана: В1 =
На эту массу колчедана и производится расчет отдельных статей материального баланса; результаты сводятся в табл. 2.1. Зачастую не весь пирит успевает сгореть в печи обжига, часть его переходит в огарок. Обычно количество несгоревшего пирита, бывает задано содержанием серы в огарке Csoгap. и для того, чтобы рассчитать массу сгоревшего пирита следует составить уравнение материального баланса по сере: Gsколч. = Gогар. + G где Gsколч. ; Gогар. ; G Массовый расход серы в колчедане Gsколч. определяется по уравнениям (2.3); (2.4) и (2.5). Массовый расход серы в огарке определяется по уравнению: Gs Огарок состоит из инертных примесей, поступающих с исходным колчеданом (Gприм.колч.), оксида железа (G Gогар. = Gприм.колч. + G
Масса инертных примесей рассчитывается по уравнению:
Gприм.колч. = Gсух.мас.колч. - G
где: Gприм.колч - массовый расход инертных примесей в колчедане, кг/ч; Gсух.мас.колч.- массовый расход сухого колчедана, кг/ч; G Массовый расход Gсух.мас.колч и G G G
Массовый расход воды в колчедане определяется из массы сухого колчедана и его влажности:
Рассчитанные массовые расходы G Массовый расход оксида железа (Fe2Оз) можно рассчитать по уравнениям (2.1) и (2.2), если известна масса сгоревшего пирита. В рассматриваемом случае массу сгоревшего пирита можно представить как разницу между исходной массой пирита в колчедане G
Тогда массовый расход оксида железа (Fe2Оз) будет равен:
Масса огарка рассчитывается по уравнению:
Gогар. = Gприм.колч. + G Масса серы в огарке:
Gsогар. =
Массовый расход серы в SО2 и SO3 равна массе серы в сгоревшем пирите:
Совместив уравнения (2.5); (2.17) и (2.18) можно получить равенство: в котором будет одна неизвестная величина - масса G Затем подсчитывается суммарная величина массы огарка (строка 9) и массовая доля всех компонентов огарка в процентном выражении. При горении пирита (уравнения (2.1) и (2.2)) образуются оксиды серы, количество молей которых в 2 раза больше количества молей сгоревшего пирита:
Количество молей
Массы SO2 и SO3 рассчитываются умножением количеств молей этих компонентов на их молекулярные массы:
и вносятся в графу 8 таблицы материального баланса (строки 7 к 8). Обжиговый газ состоит из SО2; SO3; N2; O2 и паров воды. Количество молей обжигового газа
Количество молей азота где Количество молей кислорода в воздухе:
Количество молей кислорода в обжиговом газе:
Количество молей паров воды
где C
где Робощ.- давление насьпценных паров в воздухе, Па (выбирается из табл.3 прилож. в зависимости от температуры воздуха);
Робж. - давление в печи обжига, обычно принимается равным, 105 Па
Объединением уравнений (2.25 - 2.33) получается равенство:
из которого можно определить nсух.возд. .Далее по уравнению (2.26) определяется количество молей азота
По уравнению (2.27) определяется количество молей кислорода в воздухе
По уравнениям (2.31) и (2.32) определяется количество молей воды в воздухе
Результаты расчетов по формулам (2.36), (2.37) и (2.38) вносятся в графу 5 табл. 2.1 материального баланса (строки 4, 5 и 6), подсчитывается сумма (строка 9) и рассчитывается массовая доля компонентов. Масса азота
Масса воды в обжиговом газе определяется как сумма её масс, поступающей на горение с колчеданом и воздухом:
Массы недостающих компонентов обжигового газа (азота, кислорода и воды) вносятся в графу 8 табл. 2.1 материального баланса (строки 4, 5 и 6), подсчитывается сумма по графе 8 (строка 9) и содержания компонентов в обжиговом газе (графа 9). В заключение расчета материального баланса определяются итоговые суммы по приходной и расходной статьям (строка 10) и погрешность баланса, %: b = Если погрешность баланса превышает 0,5 %, то расчет повторяется с большей точностью.
ПРИЛОЖЕНИЕ Таблица 1 Теплоемкость Ср, кДж/(н·м3·град)
Таблица 2 Теплота парообразования r н2о
Таблица 3 Давление насыщенного водяного пара
Варианты индивидуального задания
Учебное издание 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
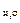 колч. - массовая доля влаги в колчедане, %;
колч. - массовая доля влаги в колчедане, %; - массовая доля SO3 в сухом обжигаемом газе, %;
- массовая доля SO3 в сухом обжигаемом газе, %; ; (2.3)
; (2.3) ; (2.4)
; (2.4) - массовая доля серной кислоты, %;
- массовая доля серной кислоты, %; - массовая доля SO3 в олеуме, %;
- массовая доля SO3 в олеуме, %; ; (2.5)
; (2.5) ; (2.6)
; (2.6) + G
+ G 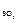 ; (2.7)
; (2.7) =
=  ; (2.8)
; (2.8) огар.) , получившегося при горении пирита, и несгоревшего пирита (G
огар.) , получившегося при горении пирита, и несгоревшего пирита (G  огар.). Масса огарка состоит:
огар.). Масса огарка состоит: огар. + G
огар. + G  огар. ; (2.9)
огар. ; (2.9) =
= 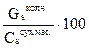 ; (2.11)
; (2.11) =
=  ; (2.12)
; (2.12) =
=  (2.13)
(2.13)  (2.14)
(2.14) ; (2.15)
; (2.15) . (2.16)
. (2.16) ; (2.17)
; (2.17) =
=  ; (2.18)
; (2.18) (2.19)
(2.19) =
= 
 . (2.20)
. (2.20) и
и  :
: ; (2.21)
; (2.21) =
=  . (2.22)
. (2.22) ; (2.23)
; (2.23) ; (2.24)
; (2.24) :
: =
=  (2.25)
(2.25) :
: · 0,79 , (2.26)
· 0,79 , (2.26) сух.возд. - количество молей сухого воздуха, поступившего в печь обжига (оно будет рассчитываться в дальнейшем).
сух.возд. - количество молей сухого воздуха, поступившего в печь обжига (оно будет рассчитываться в дальнейшем). =
=  =
=  ; (2.28)
; (2.28) будет равно сумме количества молей воды, поступившего с колчеданом
будет равно сумме количества молей воды, поступившего с колчеданом  количества молей воды, поступившего с воздухом
количества молей воды, поступившего с воздухом  возд.:
возд.: =
=  +
+ 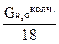 ; (2.30)
; (2.30)
 ; (2.31)
; (2.31)  ; (2.32)
; (2.32) - относительная влажность воздуха, об.д.;
- относительная влажность воздуха, об.д.; обж.газ. =
обж.газ. =  (2.33)
(2.33) (2.34)
(2.34) и их масса:
и их масса: =
=  (2.36)
(2.36) ; (2.37)
; (2.37) переносится в графу 8 табл. 2.1 материального баланса (строка 5). Расчет числа молей кислорода в обжиговом газе проводится по уравнениям (3.28) и (3.29), а затем определяется их масса по уравнению:
переносится в графу 8 табл. 2.1 материального баланса (строка 5). Расчет числа молей кислорода в обжиговом газе проводится по уравнениям (3.28) и (3.29), а затем определяется их масса по уравнению: обж.газ. =
обж.газ. =  обж.газ. =
обж.газ. =  , (2.40)
, (2.40)