
|
|
ЭКСПЕРИМЕНТ. Исследование диффузии частиц через тонкую трубку, соединяющую два объема.Нажмите кнопку <СТАРТ> и через Dt секунд после начала процесса нажмите кнопку Закончив измерения с данной трубкой, установите второе значение диаметра соединительной трубки d2 из табл.1 и повторите измерения, записывая результат в таблицу 3, аналогичную табл.2. ТАБЛИЦА 1. Значения диаметров соединительной трубки, длительности промежутка измерения и сорта частиц.
ОБРАЗЕЦ ТАБЛИЦ 2,3 для записи результатов:
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЕТА: Вычислите и запишите в таблицы все указанные значения. Постройте на одном рисунке графики экспериментальных зависимостей - Найдите среднее значение коэффициента диффузии и, используя соотношение Сделайте выводы по графику и ответу. В выводе по ответу сравните полученное экспериментально значение vср с величиной скорости, оцененной «на глаз». Вопросы и задания для самоконтроля 1. Что происходит с макросистемой при нарушении равновесия? 2. Дайте определение явления переноса. 3. Назовите примеры явлений переноса. 4. Дайте определение явления диффузии. 5. Чем обусловлена диффузия? 6. В чем проявляется диффузия? 7. Какая диффузия называется одномерной? 8. Что такое самодиффузия? 9. Напишите уравнение одномерной диффузии для двухкомпонентной системы газов. 10. Каков физический смысл коэффициента диффузии. 11. Что такое плотность тела? 12. Что такое концентрация молекул (частиц)? 13. Дайте определение градиента плотности в общем случае. 14. Напишите формулу для градиента плотности, если она меняется только вдоль оси ОХ. 15. Напишите формулу для градиента плотности, если она меняется только вдоль оси ОY. 16. Напишите формулу для градиента плотности, если она меняется только вдоль оси ОZ. 17. Напишите формулу для градиента плотности, если она меняется вдоль осей ОХ и OY. 18. Что такое длина свободного пробега частицы? 19. Что такое эффективный диаметр и эффективное сечение частицы? 20. Какое уравнение связывает среднюю скорость с коэффициентом диффузии?
ЛИТЕРАТУРА 1. Трофимова Т.И. Курс физики. М.: Высшая школа, 2001, Гл.8, §48. 2. Детлаф А.А., Яворский Б.М. Курс физики. М.: Высшая школа, 2000, Гл.10, §10.7, 10.8.
ЛАБОРАТОРНАЯ РАБОТА № 2.5 УРАВНЕНИЕ СОСТОЯНИЯ ГАЗА Ван-дер-Ваальса («Термодинамика и молекулярная физика», «Изотермы реального газа»)
ЦЕЛЬ РАБОТЫ: * Знакомство с компьютерной моделью, описывающей вещество в газообразном состоянии и его переход в жидкое состояние. * Экспериментальное подтверждение закономерностей поведения реального газа. КРАТКАЯ ТЕОРИЯ: ФИЗИЧЕСКИМ газом называется вещество, находящееся в газообразном состоянии. «идеальный газ» это название модели, описывающей физический газ, находящийся в сильно разреженном состоянии (при не слишком больших давлениях и достаточно высоких температурах). Уравнением, связывающим параметры состояния идеального газа, является уравнение Менделеева-Клапейрона. Поэтому оно имеет второе название: уравнение состояния идеального газа. Его вид известен: pV = nRT, где p - давление газа, V - объем газа, n - количество киломолей, R - универсальная газовая постоянная, T - температура газа. Более точная модель физического (реального) газа была предложена Ван-дер-Ваальсом. Она также является приближенной, но лучше описывает процессы, нежели модель «идеальный газ». Иногда эту модель называют «реальный газ». Газом Ван-дер-ваальса (ВдВ) называется воображаемый газ (модель), параметры состояния которого точно подчиняются уравнению
Оно называется УРАВНЕНИЕМ ВАН-ДЕР-ВААЛЬСА. Здесь a и b - константы Ван-дер-Ваальса. Добавка к внешнему давлению (а) обусловлена взаимным притяжением молекул друг к другу. Поправка к объему (b) характеризует ту часть объема, которая недоступна для движения молекул. Она равна нескольким суммарным объемам молекул, содержащихся в газе. ИЗОТЕРМОЙ называется зависимость давления от объема данного (фиксированного) количества вещества при постоянной температуре.
На рис.1 приведены изотермы некоторого физического (реального) газа, а на рис.2 и рис.3 - изотермы ВдВ газа. Изотерма ВдВ газа, имеющая только точку перегиба и не имеющая экстремумов, называется критической. Температура критической изотермы называется критической температурой. Объем и давление в критической точке также называются КРИТИЧЕСКИМИ. УРАВНЕНИЯ ДЛЯ КРИТИЧЕСКИХ ПАРАМЕТРОВ: VКР = 3b, pКР = При температуре выше критической вещество может находиться только в газообразном состоянии. При температуре ниже критической вещество может находиться как в газообразном, так и в жидком состоянии. Жидкое состояние описывается левыми (по отношению к точке перегиба) частями графиков на рисунках и характерно тем, что небольшое уменьшение объема вещества может произойти только при резком увеличении давления (жидкость практически несжимаема). Изотермы ВдВ примерно совпадают с изотермами реального газа на участках, соответствующих однофазным состояниям вещества. Рис.3 разъясняет поведение вещества при разных внешних условиях. В области, где присутствуют 2 фазы (1-2-3-4) S-образный завиток изотермы ВдВ заменяется горизонтальным участком (1-4) реальной изотермы. НЕРЕАЛИЗУЕМОЕ СОСТОЯНИЕ соответствует участку 2-3, на котором сжимаемость ПЕРЕОХЛАЖДЕННЫЙ ПАР на участке 3-4 реализуется при определенных условиях (при практическом отсутствии центров конденсации и внешних воздействий). ПЕРЕГРЕТАЯ ЖИДКОСТЬ на участке 1-2 реализуется при отсутствии примесей, способных быть центрами кипения.
МЕТОДИКА и ПОРЯДОК ИЗМЕРЕНИЙ:
Рассмотрите внимательно рисунок и зарисуйте необходимое в свой конспект.
ИЗМЕРЕНИЯ: ЭКСПЕРИМЕНТ 1. ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ПАРАМЕТРОВ Щелкните левой кнопкой мыши, когда ее маркер на кнопке «Выбор». Подведите маркер мыши к кнопке у верхней границы столбика на регуляторе температуры и нажмите левую кнопку мыши. Удерживая кнопку в нажатом состоянии, перемещайте границу столбика до тех пор, пока на правом экране не появится критическая изотерма с точкой перегиба и без экстремумов. Запишите в свой конспект значения критических параметров ТКР, VКР, pКР .
ЭКСПЕРИМЕНТ 2. ИССЛЕДОВАНИЕ ИЗОТЕРМ ГАЗА ВдВ. 1.Установите значение температуры, указанное первым в таблице начальных значений для вашей бригады. Нажмите мышью кнопку «СТАРТ» на экране и наблюдайте перемещение поршня на левой картинке модели и перемещение точки по красной кривой теоретической адиабаты. Попробуйте останавливать процесс нажатием кнопки «Стоп» на экране. Последующий запуск процесса осуществляется нажатием кнопки «Старт». После остановки процесса запустите его снова, нажав кнопку «Старт», и останавливайте, нажимая кнопку «Стоп», когда крестик на теоретической изотерме (красная кривая) будет находиться вблизи следующих значений объема: 0.1, 0.12, 0.14, 0.16, 0.18 и 0.2 дм3 (6 значений), записывая при остановке значения в таблицу 2. Установив новое значение температуры Т из таблицы 1, задавая Vнач = 0.1 дм3, повторите измерения, записывая результаты в таблицы 3,4,5. ТАБЛИЦА 1. Примерные значения температуры
ТАБЛИЦЫ 2,3,4,5 Результаты измерений при Т = ____ К
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЕТА: По измеренным значениям критических параметров вычислите константу А = Постройте на одном рисунке графики экспериментальных зависимостей давления от обратного объема для начальных точек всех изотермических процессов (указав на них температуры). Для каждой изотермы определите значение количества вещества, используя Вычислите среднее значение n и величину константы А’ по формуле А’ = 0.375n . Запишите ответ для А’ и проанализируйте ответы и графики. В выводах по ответу сравните А’, полученное по изотермам, с А, полученным через критические параметры.
Вопросы и задания для самоконтроля
1. Что такое физический газ? 2. Перечислите все известные агрегатные состояния вещества. 3. Что такое идеальный газ? 4. При каких условиях физический газ можно описывать моделью идеальный газ? 5. Что такое уравнение состояния? 6. Как выглядит уравнение состояния идеального газа? Каково его второе название? 7. Что такое газ Ван-дер-Ваальса? 8. Как выглядит уравнение состояния газа Ван-дер-Ваальса? Каково его второе название? 9. Что такое константы Ван-дер-Ваальса? 10. Что определяет первая константа Ван-дер-Ваальса? 11. Что определяет вторая константа Ван-дер-Ваальса? 12. Что такое изотерма? 13. Что такое критическая изотерма? 14. Каковы особенности поведения газа при температуре, выше критической? 15. Каковы особенности поведения газа при температуре, ниже критической? 16. На каких участках изотермы ВдВ примерно совпадают с изотермами реального газа?
ЛИТЕРАТУРА 1. Трофимова Т.И. Курс физики. М.: Высшая школа, 2001, Гл.10, §60-62. 2. Детлаф А.А., Яворский Б.М. Курс физики. М.: Высшая школа, 2000, Гл.12.
ЛАБОРАТОРНАЯ РАБОТА № 2.6 ЦИКЛ КАРНО («Молекулярная физика и термодинамика», «Цикл Карно»)
ЦЕЛЬ РАБОТЫ: 1. Знакомство с компьютерной моделью, иллюстрирующей цикл Карно в идеальном газе. 2. Экспериментальное определение работы, совершённой газом за цикл. 3. Экспериментальная проверка теоремы Карно. КРАТКАЯ ТЕОРИЯ: ЦИКЛОМ КАРНО называется круговой процесс, состоящий из двух изотермических процессов и двух адиабатических процессов. ( См. окно теории.) РАБОЧИМ ТЕЛОМ называется термодинамическая система, совершающая процесс и предназначенная для преобразования одной формы передачи энергии - теплоты или работы - в другую. Например, в тепловом двигателе рабочее тело, получая энергию в форме тепла, часть её передаёт в форме работы. НАГРЕВАТЕЛЕМ (ТЕПЛООТДАТЧИКОМ) называется устройство, сообщающее рассматриваемой термодинамической системе энергию в форме тепла. ХОЛОДИЛЬНИКОМ (ТЕПЛОПРИЁМНИКОМ) называется система (окружающая среда или специальные устройства для охлаждения и конденсации отработанного пара), поглощающая часть тепла рабочего тела. ПРЯМЫМ ЦИКЛОМ называется круговой процесс, в котором рабочее тело совершает положительную работу: РАБОТА любого теплового двигателя состоит из повторяющихся циклов, каждый из которых включает в себя получение рабочим телом энергии от нагревателя, расширение рабочего тела и совершение им работы, передачу части энергии холодильнику и возвращение рабочего тела в исходное состояние. Работа, совершаемая рабочим телом за один полный цикл, складывается из работы, совершённой им при расширении, и работы, совершённой им при сжатии: А = Арасш + Асж. Учитывая, что при сжатии газ совершает отрицательную работу, последнее равенство можно переписать в виде: А = Арасш При наличии холодильника газ перед сжатием или во время сжатия охлаждается, и потому процесс совершения им работы при сжатии протекает при меньшем давлении, чем при расширении. Поэтому |Асж| < Арасш, и, следовательно, А>0.
От нагревателя с температурой Т1 за цикл отнимается количество теплоты Q1, а холодильнику с температурой Т2 за цикл передаётся количество теплоты Q2. Рабочее тело при этом совершает полезную работу А = Q1 - Q2, где изотермическое расширение и сжатие изображены на рисунке окна опыта соответственно кривыми 1-2 и 3-4, а адиабатическое расширение и сжатие – кривыми 2-3 и 4-1. При изотермическом процессе U=const, поэтому количество теплоты Q1,полученное газом от нагревателя, равно работе расширения А12, совершаемой газом при переходе из состояния 1 в состояние 2: А12= При адиабатическом расширении 2-3 теплообмен с окружающей средой отсутствует, и работа расширения 2-3 совершается за счёт изменения внутренней энергии газа:
Количество теплоты Q2, отданное газом холодильнику при изотермическом сжатии, равно работе сжатия А34: А34= Работа адиабатического сжатия А41= Работа, совершаемая в результате прямого кругового цикла Карно А = А12 + А23 + А34 + А41= Q1 + A23 – Q2 – А23=Q1 - Q2. (5) Тогда термический к.п.д. цикла Карно будет равен
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ:
1. Установите температуры Т1 и Т2, указанные в табл.1 для вашей бригады. Для этого нажмите кнопку «ВЫБОР», переместите маркер мыши так, чтобы его остриё находилось на кнопках регуляторов термометров sили r. Последовательными короткими нажатиями на эти кнопки установите заданные температуры нагревателя и холодильника. 2. Нажмите мышью кнопку «СТАРТ» и наблюдайте перемещение точки по замкнутой кривой цикла Карно. Остановите процесс нажатием кнопки «СТОП» вблизи точки 1, обозначенной на рис.2, т.е. в месте перехода изотермического расширения газа в адиабатическое. 3. Запишите в табл.2 значение V2, которое в момент остановки процесса в точке 1 будет обозначено в нижнем прямоугольнике окна опыта. 4. Аналогичные измерения проведите для точек 3,4 и 1 и запишите значения объёмов газа в соответствующие столбцы таблицы 2. 5. Установите вторые значения температуры нагревателя и холодильника, указанные в табл.1, и проделайте все измерения по пп 2- 4 ещё раз. Результаты опытов занесите в табл.3. ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЁТА: 1.Для любой произвольной точки цикла запишите значения давления, объёма и температуры, указанные в прямоугольнике окна опыта. 2. С помощью уравнения состояния идеального газа pV= 4. Используя уравнения 1, 3 и 5 рассчитайте Q1, Q2, A и запишите эти значения в табл.2. 5.По формуле (6) рассчитайте к.п.д. цикла Карно и сравните его со значением, приведённым в окне опыта. 6.Вычислите среднее значение работы цикла Карно и абсолютную погрешность измерения А.
Таблица 1. Значения температуры нагревателя Т1 и холодильника Т2
Таблицы 2,3. Результаты измерений (количество измерений и строк = 3)
Т1= Т2= Вопросы и задания для самоконтроля
1. Из каких основных элементов состоит тепловой двигатель? 2. Зачем в тепловом двигателе нужен холодильник? 3. Что является холодильником в двигателе внутреннего сгорания? 4. Чем отличаются обратимые и необратимые процессы? Почему все реальные процессы необратимы? 5. Дайте понятие энтропии (определение, размерность и математические выражения изменения энтропии для различных изопроцессов идеальных газов). 6. В каком направлении может изменяться энтропия замкнутой системы? незамкнутой системы? 7. В чём заключается теорема Карно? 8. Выведите формулу к.п.д. цикла Карно. 9. Изобразите в системе координат T-S изотермический и адиабатический процессы и цикл Карно в целом. 10. Докажите, что к.п.д. теплового двигателя, работающего по произвольному обратимому циклу, всегда меньше, чем к.п.д. цикла Карно, работающего между максимальной и минимальной температурой этого цикла.
ЛИТЕРАТУРА 1. Трофимова Т.И. Курс физики. М.: Высшая школа, 2001, Гл.9, §59. 2. Детлаф А.А., Яворский Б.М. Курс физики. М.: Высшая школа, 2000, Гл.11, §11.2.
ЛАБОРАТОРНАЯ РАБОТА № 2.7 ПОЛИТРОПИЧЕСКИЙ ПРОЦЕСС («Термодинамика и молекулярная физика», «Работа газа»)
ЦЕЛЬ РАБОТЫ: =Ознакомление с основами анализа и моделирования термодинамических процессов в идеальных газах. =Определение молярной теплоёмкости в политропических процессах идеального газа. =Определение показателя адиабаты и работы газа в политропическом процессе.
КРАТКАЯ ТЕОРИЯ: ПОЛИТРОПНЫМ называется процесс, в котором молярная теплоёмкость С остаётся постоянной. Уравнение политропического процесса имеет вид: рV n = const , (1) где n = МОЛЯРНОЙ ТЕПЛОЁМКОСТЬЮ называется физическая величина С, численно равная теплоте С = Выражение (3) теперь можно записать в форме
или в интегральной форме Таким образом, если количество тепла, полученное в некотором термодинамическом процессе 1®2 при m = const, прямо пропорционально разности температур
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ для любого равновесного процесса изменения состояния идеального газа имеет вид
Тогда из уравнения (5) имеем: C = Cv + Связь между объёмом газа и его температурой в политропном процессе можно найти из выражения (1) и уравнения Клапейрона – Менделеева
Дифференцируя последнее выражение, получим:
Тогда уравнение (6) примет вид:
Учитывая, что
или Таким образом, если термодинамический процесс идеального газа действительно является политропным, т.е. молярная теплоёмкость в ходе процесса не изменяется, то её величина рассчитывается по формуле (7). В настоящей работе используется модель одноатомного газа (i =3), поэтому в политропных процессах при n = -1 согласно выражению (7) молярная теплоёмкость С должна быть равна 16,6 Дж/моль×К, а при n = -2, C = 15,2 Дж/моль×К. Частными случаями политропного процесса являются: 1) изотермический: n = 1, C = ± ¥; 2) изобарический: n = 0, C = Cp; 3) изохорический: n = ±¥, С = Сv; 4) адиабатический: n = g, где g =
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ:
1. В прямоугольном окошке «Функция» нажмите маркером мыши кнопку «Прямая». 2. Подведите маркер мыши к выделенной левой точке графика р = f(V) на экране монитора, нажмите левую кнопку мыши, и, удерживая её в нажатом состоянии, переместите начало графика в точку с координатами (Р1,V1,Т1), взятыми из таблицы 1 для вашей бригады. 3. Аналогичным образом переместите выделенную крайнюю правую точку графика в точку с координатами (Р20, V20). 4. На мониторе щёлкните мышью кнопку;в верхнем ряду кнопок, а в нижней части экрана кнопку «СТАРТ». 5. 6. Последовательно повторяя действия п.5 20 раз, заполните таблицу 2. 7. В прямоугольном окошке «Функция» нажмите маркером мыши кнопку «Парабола», проделайте измерения п.п. 2-6 и запишите результаты опытов в табл.3. 8. В прямоугольном окошке «Функция» нажмите маркером мыши кнопку «Экспонента», проделайте измерения п.п. 2-6 и запишите результаты опытов в табл.4.
ТАБЛИЦА 1. Начальные и конечные параметры для трёх термодинамических процессов
ТАБЛИЦЫ 2,3,4. Результаты измерений температуры и количества выделения тепла в ходе термодинамического процесса расширения газа Табл.2, функция «прямая» Табл.3, функция «парабола» Табл.4, функция «экспонента»
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЁТА
1.Вычислите и запишите во вторую строку таблиц 2, 3, 4 разности температур Ti-T1. 3. На миллиметровой бумаге или на листе в клетку формата А4 постройте по экспериментальным точкам графики в виде линейной зависимости 4. По тангенсу угла наклона прямой линии графика к оси разности температур, используя формулу 5. Рссчитайте работу газа в этих процессах по формуле
и сравните эти значения со значениями, указанными в нижнем окне монитора при p20 и V20 . 6. Проанализируйте полученные результаты , сделайте оценку погрешности измерений.
Вопросы и задания для самоконтроля
1. Сформулируйте закон Больцмана о равнораспределении энергии по степеням свободы молекул. 2. Почему колебательная степень свободы молекулы обладает вдвое большей энергией, чем поступательная и вращательная? 3. В чём состоит качественная неравноценность между работой и теплообменом как формами передачи энергии? 4. Что такое внутренняя энергия идеального газа? 5. В результате каких процессов может изменяться внутренняя энергия идеального газа? 6. Что называется молярной теплоёмкостью газа? 7. Почему Cv больше, чем CP? 8. Покажите применение первого начала термодинамики к изопроцессам в идеальных газах. 9. Чему равна работа изобарного расширения моля идеального газа при нагревании на 1К? 10. Чему равна работа изохорного расширения моля газа при нагревании на 1К? 11. Нагревается или охлаждается идеальный газ, если он расширяется при постоянном давлении? 12. Температура газа в сосуде постоянна. Запишите на основе первого начала термодинамики соотношение между сообщённым количеством теплоты и совершённой работой. 13. Газ переходит из одного и того же состояния u в одно и тоже состояние v в результате следующих процессов: 1) изотермического; 2) изобарного; 3) изохорного; 4) адиабатного. Рассмотрев эти процессы графически, показать: 1) в каком процессе работа расширения максимальна? 2) в каком случае газу сообщается большее количество тепла? 14. Какой процесс называется политропным? 15. Показатель политропы n >1. Нагревается или охлаждается идеальный газ при сжатии? 16. Определите, больше или меньше нуля молярная теплоёмкость газа в термодинамическом процессе
ЛИТЕРАТУРА 1. Трофимова Т.И. Курс физики. М.: Высшая школа, 2001, Гл.9, §55. 2. Детлаф А.А., Яворский Б.М. Курс физики. М.: Высшая школа, 2000, Гл.9, §9.6.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 сверху во внешнем окне. Результат запишите в таблицу 2. Нажмите кнопку «uu». Через Dt секунд, нажав
сверху во внешнем окне. Результат запишите в таблицу 2. Нажмите кнопку «uu». Через Dt секунд, нажав 

 , определите по графикам коэффициенты диффузии для каждого отверстия. Длину отверстия Lотв измерьте линейкой на экране монитора, объем сосуда V = 20 см3.
, определите по графикам коэффициенты диффузии для каждого отверстия. Длину отверстия Lотв измерьте линейкой на экране монитора, объем сосуда V = 20 см3. , найдите среднюю скорость теплового движения vср частиц (lср = 2 см).
, найдите среднюю скорость теплового движения vср частиц (lср = 2 см).
 .
.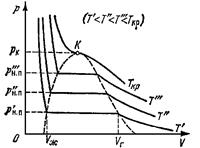 Рис.1
Рис.1
 Рис.2
Рис.2
 Рис.3
Рис.3
 , TКР =
, TКР =  . Отсюда А =
. Отсюда А =  n = 0.375n.
n = 0.375n. вещества была бы отрицательна, что невозможно.
вещества была бы отрицательна, что невозможно.
 .
. .
. >0. На графике p-V прямой цикл изображается в виде замкнутой кривой, проходимой рабочим телом по часовой стрелке.
>0. На графике p-V прямой цикл изображается в виде замкнутой кривой, проходимой рабочим телом по часовой стрелке. - | Асж|.
- | Асж|. (1)
(1) -
-  . (2)
. (2) . (3)
. (3) =-A23. (4)
=-A23. (4) =
=  . (6)
. (6)
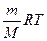 определите число молей газа, находящихся в цилиндре под поршнем.
определите число молей газа, находящихся в цилиндре под поршнем. . (2)
. (2) , которую нужно сообщить одному молю вещества для изменения его температуры на 1К в рассматриваемом термодинамическом процессе:
, которую нужно сообщить одному молю вещества для изменения его температуры на 1К в рассматриваемом термодинамическом процессе: , (3) (M- молярная масса, m- масса газа).
, (3) (M- молярная масса, m- масса газа). . (4)
. (4) .
. , то теплоёмкость газа постоянна и процесс является политропическим.
, то теплоёмкость газа постоянна и процесс является политропическим. .
. . (5)
. (5) . (6)
. (6) :
: .
. ,
, .
. .
. , где
, где  показатель адиабаты, получим:
показатель адиабаты, получим: .
. . (7)
. (7) , С = 0.
, С = 0.


 Q и Т.
Q и Т. Q
Q


 от разности температур Ti-T1 для трёх исследуемых процессов. (Каждый график на отдельном листе!).
от разности температур Ti-T1 для трёх исследуемых процессов. (Каждый график на отдельном листе!). , определите молярную теплоёмкость политропического процесса и сравните её с теоретическим значением, рассчитанным по формуле (7).
, определите молярную теплоёмкость политропического процесса и сравните её с теоретическим значением, рассчитанным по формуле (7).
 , если а) газ одноатомный; 2) газ двухатомный.
, если а) газ одноатомный; 2) газ двухатомный.