|
|
Что влияет на выбор препаратов для премедикации?После того как определены цели премедикации, выбор препаратов определяется их клиническим эффектом. Например, при боли, обусловленной переломом бедра, назначение опиоидов (например, морфина, меперидина) уменьшит дискомфорт, вызванный транспортировкой в операционную и укладкой на операционный стол. Депрессия дыхания, ортостатическая гипотония и тошнота — недостатки премедикации опиоидами. Барбитураты — эффективные седативные средства, но они не обладают аналитической активностью и вызывают депрессию дыхания. Бензодиазе-пины устраняют тревожность, часто вызывают амнезию, дают относительно мало побочных эффектов, но, подобно барбитуратам, не являются аналгетиками. Существуют лекарственные формы диазепама и лоразепама для приема внутрь. При в/м введении мидазолама действие наступает быстро (через 30 мин) и продолжается недолго (90 мин). Дисфория, продолжительный седатив-ный эффект и блокада α-адренорецепторов ограничивают клиническое применение дроперидола. Другие препараты для премедикации обсуждаются в следующих главах: холиноблокаторы — в гл. 11, антигистаминные, противорвотные и ан-тациды — в гл. 15. Как проводить премедикацию у данной больной? Во-первых, больной следует объяснить, что из соображений безопасности анестезию нельзя начинать вне операционной. Препараты продолжительного действия (например, морфин и дроперидол) нецелесообразно использовать в амбулаторной хирургии. Лоразепам и диазепам влияют на психику в течение нескольких часов. Приемлемый вариант: в предоперационной устанавливают систему для внутривенных инфузий и дробно вводят низкие дозы мидазолама, при необходимости вместе с фентанилом. После того как речь больной станет спутанной, ее можно транспортировать в операционную. Следует непрерывно наблюдать за основными физиологическими параметрами, особенно за частотой дыхания. Избранная литература Estafanow F. G. (ed.). Opioids in Anesthesia IІ Butter-worth-Heineman, 1990. Сборник выступлений на симпозиуме; содержит как конкретную информацию, так и сведения по теоретической фармакологии. Feldman S. A., Paton W., Scurr C. (eds). Mechanisms of Drugs in Anaesthesia, 2nd ed. Hodder & Stoughton, 1993. Fragen R. J. (ed.). Drug Infusions in Anesthesiology. Raven Press, 1991. Информация о фармакоки-нетике препаратов и оборудовании, необходимая для полноценного использования инфузионных систем введения лекарственных средств. Hull С. J. Pharmacokinetics for Anesthesia. Butter-worth-Heinemann, 1991. Прекрасная работа, посвященная фармакокинетике неингаляционных и, в меньшей степени, ингаляционных анестетиков. Miller R. D. (ed.). Lessons learned from a phase IV stady of propofol: Analysis of data of over 25 000 patients. Anesth. Analg., 1993; 77(4S): 1-50. Информация об объеме научных исследований, которые необходимы для поступления нового лекарственного препарата на рынок и последующего контроля безопасности его применения. Reich D. L, Silvay G. Ketamine: An update on the first twenty-five years of clinical expirience. Can. J. Anaesth., 1989; 36: 186. Эволюция взглядов о применении кетамина в анестезиологии. Smith I. et al. Propofol: an update on its use. Anes-thesiol., 1994; 81; 1005. Stanski D. R., Watkins W. D. Drug Disposition in Anesthesia. Grune & Stratton, 1982. Stein C. Peripheral mechanisms of opioid analgesia. Anesth. Analg., 1993; 76: 182-191. Stocking R. K. Pharmacology and Physiology in Anesthetic Practice, 2nd ed. Lippinscott, 1991.
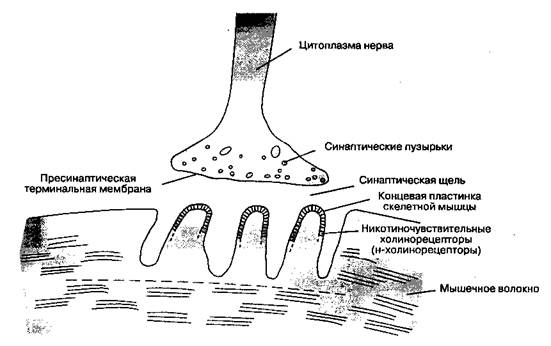
Глава 9 Миорелаксанты Расслабление скелетных мышц может быть вызвано регионарной анестезией, высокими дозами ингаляционных анестетиков, а также препаратами, блокирующими нервно-мышечную передачу (их общепринятое название — миорелаксанты). В 1942 г. Гарольд Гриффит опубликовал результаты применения очищенного экстракта кураре (яда, которым южноамериканские индейцы смазывали наконечники стрел) при анестезии. Миорелаксанты быстро стали неотъемлемой частью лекарственного арсенала анестезиолога. Как отметил Гриффит, миорелаксанты вызывают расслабление скелетных мышц, а не анестезию. Иными словами, миорелаксанты не приводят к утрате сознания, амнезии и аналгезии. В настоящей главе описаны принципы нервно-мышечной передачи и представлены механизмы действия, структура, пути выведения, дозы и побочные эффекты некоторых миорелаксантов. Нервно-мышечная передача Место, где мотонейрон вступает в контакт с мышечной клеткой, называется нервно-мышечным синапсом(рис. 9-1). Клеточные мембраны мотонейрона и мышечной клетки разделены узким промежутком (20 нм) — синаптической щелью.Когда потенциал действия деполяризует терминаль мотонейрона, ионы кальция поступают извне в цитоплазму нерва, что вызывает слияние синап-тических пузырьков с пресинаптической терминальной мембранойи высвобождение содержащегося в них ацетилхолина в синаптическую щель.
Рис. 9-1.Нервно-мышечный синапс Молекулы ацетилхолина диффундируют через синаптическую щель и взаимодействуют с никоти-ночувствительными холинорецепторами(н-холи-норецепторами) специализированной части мембраны мышечной клетки — концевой пластинкой скелетной мышцы. Каждый холинорецептор состоит из пяти белковых субъединиц, две из которых (α-субъедини-цы) одинаковы и способны связывать молекулы ацетилхолина (одна α-субъединица — одно место связывания). Если оба места связывания заняты двумя молекулами ацетилхолина, то конформация субъединиц изменяется, что приводит к кратковременному (на 1 мс) открыванию ионного канала, проходящего через толщу рецептора (рис. 9-2). Через открытый канал начинают поступать катионы (натрий и кальций — извне внутрь клетки, калий — из клетки наружу), что вызывает появление потенциала концевой пластинки. Содержимое одного синаптического пузырька — квант ацетилхолина — вызывает миниатюрный потенциал концевой пластинки(1 квант — 10 000 молекул ацетилхолина). Если ацетилхолином занято достаточное количество рецепторов, то суммарный потенциал концевой пластинки становится достаточно мощным для того, чтобы деполяризовать постсинаптическую мембрану вокруг синапса. Натриевые каналы в этой части мембраны мышечной клетки открываются под воздействием разности потенциалов (в отличие от каналов в рецепторах концевой пластинки, которые открываются при взаимодействии с ацетилхолином). Возникающий потенциал действияраспространяется вдоль мембраны мышечной клетки и системы Т-трубочек, что вызывает открывание натриевых каналов и выброс ионов кальция из цистерн саркоплазматической сети. Высвобожденный кальций опосредует взаимодействие сократительных белков актина и миозина, что приводит к сокращению мышечного волокна. Количество высвобожденного ацетилхолина обычно значительно превосходит минимум, необходимый для развития потенциала действия. Некоторые заболевания нарушают процесс нервно-мышечной передачи: при миастеническом синдроме Итона-Ламберта высвобождается недостаточное количество ацетилхолина, при миастении (myasthenia gravis) снижено число холинорецепторов. Субстратспецифический фермент ацетилхо-линэстераза быстро гидролизует ацетилхолин на уксусную кислоту и холин. Молекулы этого фермента (называемого также специфической,или истинной, холинэстеразой)фиксированы в концевой пластинке в непосредственной близости от холинорецепторов. В конечном счете ионные каналы закрываются, что приводит к реполяриза-ции концевой пластинки. Когда распространение потенциала действия прекращается, ионные каналы в мембране мышечного волокна тоже закрываются. Кальций поступает обратно в сарко-плазматическую сеть, и мышечное волокно расслабляется.
Рис.9-2. Связывание ацетилхолина с рецептором концевой пластинки скелетной мышцы приводит к открыванию канала и вызывает ионный ток 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|