
|
|
ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ СТРУКТУРЫ КРИСТАЛЛОВ127. Найдите зависимость между коротковолновой границей тормозного рентгеновского спектра и ускоряющим напряжением, приложенным к трубке. 128. При увеличении напряжения на рентгеновской трубке в полтора раза длина волны коротковолновой границы сплошного рентгеновского спектра изменилась на Äë = 10 пм. Найдите первоначальное напряжение на трубке. 129. Можно ли найти координаты атомов структурными методами анализа (рентгеновская, электронная или нейтронная дифракции), если образец представляет собой: а) монокристалл, б) поликристалл, в) текстуру. 130. Может ли á K -излучение железа вызвать вторичное рентгеновское излучение К-серии хрома и кобальта? 132. Найдите формулу расчета F(hkl) для кристаллов с ячейкой Бравэ F-типа. 133. Определите правила погасания для кристаллов с ячейкой Бравэ I-типа. 134. Запишите формулу для расчета структурной амплитуды кристаллов с центром симметрии и кристаллов с осью 2z. 135. Выведите уравнение Вульфа-Брэгга. 136. Получите из построения Эвальда соотношение Вульфа-Брэгга. 146. Установите связь между ускоряющим напряжением в электронной пушке и длиной волны электрона. 147. Чему равно ускоряющее напряжение в электронной пушке, если длина волны электрона равна 0.1226 oA ? 148. Найдите , если = 300 , а d n = 2.5 oA .
149. Опишите принципы рентгеновского, электронографического и нейтронографического фазовых анализов (качественного и количественного) двухфазной системы. Задача 149. Простейший алгоритм фазового анализа двухкомпонентной системы следующий. 1. Исследуется химический состав образца. 2. По химическому составу рассматриваются возможные кристаллохимические фазы. 3. Производится съемка рентгенограммы образца с последующим определением dn и I (межплоскостных расстояний и интенсивностей рефлексов). 4. Для всех кристаллических фаз, возможных для данного состава образца, либо выбираются из таблиц значения dn и I, либо определяются экспериментально, если конкретную фазу можно исследовать в чистом виде. 5. Сравнивая значения dn, I образца с таблицами dn и I отдельных фаз, определяется их наличие или отсутствие в образце. 6. Определив фазовый состав образца, переходят к количественному анализу, для чего составляются эталонные образцы с известным содержанием этих двух фаз. 7. Получают рентгенограммы от эталонных смесей и находят зависимость отношений I 1 /I 2 = f (C 1), которую обычно изображают графически. Индексы 1 и 2 относятся к фазам, кроме того, C1 + C2 = 1. Съемку рентгенограмм эталонов проводят по той же методике, что и съемка исследуемого образца. 8. По рентгенограмме образца находят отношение интенсивностей рефлексов, для которых построена функция I1/ I2= f(C) , и по эталонному графику находят C1 = 1 - C2 . На практике возможны модификации приведенного стандартного алгоритма качественного и количественного рентгеновского фазового анализа. Если вместо рентгеновского излучения используют электронные или нейтронные пучки, то в этом случае реализуются методики качественного и количественного электронографического (или нейтронографического) фазового анализа двухкомпонентной системы по описанному алгоритму. xx. Доказать, что, в соответствии с правилами Браве, гранецентрированная тетрагональная решетки Браве сводится к объемно-центрированной. Хх. См. рис. Хх. xx.Связь между размерами элементарной ячейки в гексагональной (aH,cH) и ромбоэдрической (aR, aR) установками. xx. aH=2aRsin(aR/2), cH=aR[(9-12sin2(aR/2)]1/2 aR=[(3aH2+cH2)1/2/3, sin(aR/2)=3/{2[3+(cH/aH)2]1/2
xx. Вывести уравнение Брэгга-Вульфа 2dsinq = nl. xx. Разность хода лучей 1 и 2 (см. рис. Хх) равна: D = AB + BC – AD = 2dsinQ – ACcosQ = 2d/sinQ - 2dcosQ/tgQ = (2d/sinQ)(1 - cos2Q) = 2dsinQ = nl.
хх. Определить зависимость погрешности определения величины межплоскостного расстояния Dd от угла отражения Q. xx. 2dsinQ = nl, d = nl/2sinQ, Dd = -nlcosQDQ/2sin2Q = -nlcosQDQ/(nl/2d)2sinQ = -2dtgQDQ.
Хх. Пример вывода всех черно-белых групп GM из группы G = 2/m приведен в таблице хх.
Задачи по термодинамике xx. Вычислить работу, совершенную идеальным газом при адиабатическом расширении от объема V1 до объема V2. Хх. A = ∫V1V2pdV = ∫V1V2RTdV/V = RTln(V2/V1) (p = RT/V)
xx. Определить зависимость давления идеального газа от температуры по молекулярно-кинетической теории. хх. fixDt= Dpix=2miuix; Dt=2l/uix, fix = miuix2/l. Dt – время столкновения между двумя последовательными ударами о стенку куба с длиной ребра l. Fx=Sifix, px=Fx/l2=py=pz=p, 3p=(l/l2)Simiui2/l. pV=(1/3)Simiui2 = (2/3)noW no – число молекул в единице объема, W=mu2/2 – средняя кинетическая энергия поступательного движения молекулы газа pV=(1/3) Simiui2 =nmu2/3 p=(2/3)noW (уравнение Клаусиуса) Для одного моля газа pV = (2/3)NAW=(2/3)NA3kBT/2=RT. (Объем одного моля равен 22,4 л, R=8,3 Дж/моль К). W=mu2/2, W=mu2/2=3kBT/2, p=nokBT, kB=R/NA.
хх. Идеальный газ с температурой Т расширяется из объема V1 в вакуум в отсутствие теплообмена. Объем конечного состояния равен V2. Определить увеличение энтропии системы. Хх. dS=pdV/T +dU/T=RdV/V, DS= Rln(V2/V1). (pV=RT)
хх. Определить изменение энтропии N молей идеального газа при изменении температуры от T1 до T2 при а) постоянном давлении, б) при постоянном объеме. Хх. a) dSp=cpdT/T, DSp=cpln(T1/T2); б) dSV=cVdT/T, DSV=cVln(T2/T1).
хх. Определить КПД тепловой машины, работающей по циклу Карно. Хх.
хх. Установить, что для любой простой системы, подверженной действию обобщенной силы А, сопряженной внешнему параметру а, справедливо соотношение (∂T/∂A)a(∂A/∂a)T(∂a/∂T)A=-1. Хх. dA=(∂A/∂a)Tda + (∂A/∂T)adT, при dA=0 (∂A/∂a)T(∂a/∂T)A + (∂A/∂T)a=0, → (∂T/∂A)a(∂A/∂a)T(∂a/∂T)A=-1. При A=p, a=V, a= (1/Vo1)(∂V/∂T)p, b=(1/Vo2)(∂V/∂p)T, g=(1/po))(∂p/∂T)V. aVo1/bVo2g ≈ a/bg= -po.
хх. Вычислить вероятность передачи теплоты 10-7 Дж от тела с температурой Т1=301 К к телу с T2=300 К и наоборот. хх. DS=S2-S1= 10-7/300-10-7/301= kln(w2/w1); w2/w1=exp(DS/k) ≈ exp(1012/12 = (100010)10. На каждые (100010)10 случаев перехода 10-7 Дж от тела с Т1=301 К к телу с T2=300 К может произойти один переход того же количества теплоты от тела с T2=300 К к телу с Т1=301 К.
хх. Определить зависимость химического потенциала идеального газа от давления при постоянной температуре. Хх. dG = -SdT + Vdp + mdn При T=const V = nRT/p = (∂G/∂p)T,n, Интегрируя получим: G = Go + nRTln(p/po) m = (∂G/∂n)T = mo + RTln(p/po)
Хх. Стандартные энтальпии образования жидкой и газообразной воды при 298 К равны -285,8 и -241,8 кДж/моль, соответственно. Рассчитать энтальпию испарения воды при этой температуре. Хх. 1. H2 (г) +O2 (г) = H2O (ж) DHo1=-285,8 2. H2 (г) +O2 (г) = H2O (т) DHo2=-241,8 3. H2O (ж) = H2O (г) DHo3 = ?? DHo1 + DHo3 = DHo2 DHo3= 44,0 Дж/моль.
хх. Рассчитать энтальпии реакции 6C (г) + 6H (г) = C6H6 (г) по а) энтальпиям образования DfHo(C6H6) (газ) =82,93, DfHo(C) (газ) =716,68, DfHo(H) (газ) =217,97; б) по энергиям связи, в предположении, что двойные связи в молекуле C6H6 фиксированы: E(C-C)=348, E(C-H)=412, E(C=C)=612. Хх. а). DrHo = 82,93 -6*716,68 – 6*217,97 = -5525 кДж/моль. б). В приближении двойных связей молекула C6H6 содержит шесть связей C-H, три связи C-C и три связи C=C. DrHo = -(6·412 + 3 ·348 + 3·612) = -5352 кДж/моль.
21. Определить теплоту реакции образования алмаза из графита, зная теплоты сгорания графита и алмаза. Хх. С (графит) + O2 (газ) = CO2 (г) DH=-393,51 кДж/моль С (алмаз) + O2 (газ) = CO2 (г) DH=+395,41 кДж/моль С (графит) = С (алмаз) DH=+1,9 кДж/моль
1.3. Изменение теплоты в зависимости от температуры и объема в некоторой системе описывается уравнением: δQ = CdT + (RT/V)dV (C и R - постоянные). Является ли теплота функцией состояния в данном случае? Ответ обоснуйте. 1.3. δQ = [¶QV/¶T]dT + [¶QT/¶V])dV = A(T,V)dT + B(T,V)dV. Условие того, что δQ полный дифференциал: (¶A/¶V)T = (¶B/¶T)V (¶2QV/¶T¶V = 0; ¶2QT/¶V¶T = R/T) не выполняется.
1.4. Уравнение состояния системы имеет вид p = p(T,V). Доказать, что между частными производными существует соотношение (¶p/¶T)V(¶T/¶V)p(¶V/¶p)T = -1. 1.4. W(T, V, p) = 0. Задает неявно p = z(V,T). dp = (¶p/¶T)VdT + (¶p/¶V)TdV при p = const 0 = (¶p/¶T)V(∂T/∂V)p + (¶p/¶V)T ⇒ (¶p/¶T)V(¶T/¶V)p(¶V/¶p)T = -1. a =(¶V/¶T)p/Vo1 – изобарический коэффициент теплового расширения (p = const), b = (¶p/¶T)V/po – термический коэффициент давления (V = const), k = -(¶V/¶p)T/Vo2 – изотермическая сжимаемость. Отсюда: pobk Vo2/Vo1a ≈ pobk/a = -1.
1.5. Доказать, что между адиабатической сжимаемостью ba = -(1/V) (¶V/¶p)a и изотермической сжимаемостью bT = - (1/V)(¶V/¶p)T имеется соотношение ba = bT (CV/Cp). ХХХххх.
1.6. Вычислить работу, производимую N молями идеального газа при изотермическом расширении от начального объема V1 до конечного объема V2 . 1.6. A = ∫V1V2pdV = NRTln(V2/V1) 1.7. Вычислить работу, совершаемую идеальным газом при адиабатическом расширении от объема V1 до объема V2 . Ххххххх
1.8. Внутренняя энергия e единицы объема газа зависит только от T, а уравнение состояния имеет вид p = e(T)/3. Найти внутреннюю энергию и энтропию газа. ХХххххх
1.9. Доказать, что внутренняя энергия системы, уравнение состояния которой имеет вид p= f(p)T не зависит от объема. ХХхххххх
1.10. Идеальный газ, имеющий температуру T, расширяется из объема V1 в вакуум в отсутствие теплообмена. Объем конечного состояния равен V2 . Определить увеличение энтропии газа. 1.10. dS = (p/T)dV = RdV/V, DS = Rln(V2/V1). (p = RT/V)
1.11. Определить изменение энтропии N молей идеального газа при изменении его температуры от T1 до T2 : а) при постоянном давлении, б) при постоянном объеме. 1.11. a) dSp = CpdT/T, DSp = Cpln(T2/T1). б) dSV = CVdT/T, DSV = CVln(T2/T1).
1.12. В двух частях сосуда, разделенных выдвижной перегородкой, находятся два различных идеальных газа, числа молей которых равны N1 и N2 . Температуры и давления обоих газов одинаковы. После выдвижения перегородки происходит диффузионное смешение газов. Доказать, что в результате этого процесса энтропия газов изменяется на величину DS = -R[N1ln[N1/(N1+N2)] + N2ln[N2/(N1+N2)]. 1.12. xxxxxxx
1.13.Используя первый закон и определение теплоемкости, найдите разность изобарной и изохорной теплоемкостей для произвольной термодинамической системы. 1.13. В определение теплоемкости (2.6) подставим дифференциальное представление первого закона (2.1) и используем соотношение (2.13) для внутренней энергии как функции температуры и объема: С = δQ/dT = (dU + pdV)/dT = [CVdT + (∂U/∂V)TdV + pdV]/dT = CV + [(∂U/∂V)T + p](dV/dT).
1.14. Стандартные энтальпии образования жидкой и газообразной воды при 298 К равны -285.8 и -241.8 кДж/моль, соответственно. Рассчитайте энтальпию испарения воды при этой температуре. 1.14. Энтальпии образования соответствуют следующим реакциям: H2(г) + (1/2)O2(г) = H2O(ж), DH10 = -285,8; H2(г) + (1/2)O2(г) = H2O(г), DH20 = -241,8. Вторую реакцию можно провести в две стадии: сначала сжечь водород с образованием жидкой воды по первой реакции, а затем испарить воду: H2O(ж) = H2O(г), DH0исп = ? Тогда, согласно закону Гесса, DH10+DH0исп = DH20, откуда DH0исп =-241,8+285,8=44,0 кДж/моль. Ответ. 44,0 кДж/моль. 1.15. Рассчитать энтальпию реакции 6C(г) + 6H(г) = C6H6(г) а) по энтальпиям образования; б) по энергиям связи, в предположении, что двойные связи в молекуле C6H6 фиксированы. 1.15. а) Энтальпии образования (в кДж/моль) находим в справочнике (например, P.W. Atkins, Physical Chemistry, 5th edition, pp.C9-C15): DfH0(C6H6(г)) = 82,93, DfH0(C(г)) = 716,68, DfH0(H(г)) = 217,97. Энтальпия реакции равна: DrH0 = 82,93 - 6 б) В данной реакции химические связи не разрываются, а только образуются. В приближении фиксированных двойных связей молекула C6H6 содержит 6 связей C - H, 3 связи C - C и 3 связи C = C. Энергии связей (в кДж/моль) (P.W. Atkins, Physical Chemistry, 5th edition, p.C7): E(C - H) = 412, E(C - C) = 348, E(C = C) = 612. Энтальпия реакции равна: DrH0 = -(6 Разница с точным результатом -5525 кДж/моль обусловлена тем, что в молекуле бензола нет одинарных связей C - C и двойных связей C = C, а есть 6 ароматических связей C Ответ. а) -5525 кДж/моль; б) -5352 кДж/моль. . 1.16. Какой физический смысл следующих понятий: термодинамическое равновесие, равновесное состояние, термодинамический процесс, квазистатический процесс? 1.16. Хххххххх Термодинамический процесс связан с изменением хотя бы одной термодинамической переменной. Процессы, протекающие самопроизвольно, называются положительными. Они приближают систему к состоянию равновесия, идут без затраты работы, и даже более того, с их помощью можно получить работу. Процессы, обратные положительным, называются отрицательными. Они могут идти только при затрате энергии извне или при сопряжении с положительными процессами внутри системы. В результате этих процессов система удаляется от равновесного состояния.
1.17. Как определяется температура в термодинамике и в молекулярно- кинетической теории. Хххххххх
1.18. Сформулируйте нулевой закон термодинамики. 1.18. Постулат существования состояния термодинамического равновесия (первое исходное положение термодинамики): - вне зависимости от начального состояния изолированной системы, в конце концов, в ней при фиксированных внешних условиях установится термодинамическое равновесие, в котором её макроскопические параметры остаются неизменными с течением времени и из которого система не может выйти самопроизвольно. - второе исходное положение, или нулевой закон термодинамики (постулат о существовании температуры) описывает свойства систем, находящихся в состоянии теплового равновесия: - если система А находится в тепловом равновесии с системой В, а та, в свою очередь, находится в равновесии с системой С, то системы А и С также находятся в тепловом равновесии.
1.19. Что называют уравнением состояния. Как записать это уравнение для идеального газа: 1.19.Уравнение состояния термодинамической системы. Из нулевого закона следует, что при равновесии внутренние параметры системы являются функциями внешних параметров и температуры. Уравнение, связывающее внутренние параметры с внешними параметрами и с температурой, называют уравнением состояния термодинамической системы. В общем случае уравнение состояния имеет вид: f(a,b,T) = 0 или a = f(b,T), где a - совокупность внутренних параметров, b - совокупность внешних параметров, T - температура. Так же, как и начала, уравнения состояния не выводятся методами классической термодинамики, они берутся из опыта или из статистической физики. В отличие от начал термодинамики, уравнения состояния не носят всеобъемлющего характера, а применимы только для конкретных термодинамических систем. Уравнение для идеального газа: pV = (m/M)RT.
1.20. Уравнение адиабаты. Показать, что кривая адиабаты p(V) круче кривой изотермы p(V). 1.20. Ххххххх
1.21. Формула Майера:. cp – cV для идеального газа. 1.21. Из уравнения δq/dT = dU/dT + δA/dT, (2.1) следует, что для условий V = const справедливо следующее: (δq/dT)V = dU/dT + pdV/dT = cV. (2.3) Для изобарических условий ведения процесса (р = const): cp = (δq/dT)p = dU/dT + d(pV)/dT = d(U + pV)/dT = dH/dT. (2.5) Сравним cV и cР: cp – cV = dH/dT – dU/dT = dU/dT + pdV/dT – dU/dT = pdV/dT. (2.6) Из уравнения состояния идеального газа: V = RT/p. (2.7) Тогда (2.6) с учетом (2.7) запишется в виде (2.8): cp – cV = pdV/dT = pd(RT/p)dT = R.
1.22.cp – cV для твердого тела. TVoa2/k a=V-1(¶V/¶T)p – изобарический коэффициент линейного расширения, k = -V-1(¶V/¶p)T – изотермический коэффициент сжатия, Vo - молярный объем вещества при 0 К. 1.22. cp – cV = dH/dT – dU/dT = dU/dT + pdV/dT – dU/dT = pdV/dT. (¶U/¶T)V = CV, (¶U/¶V)T = T(¶p/¶T)V – p). Используя определение Cp = T(¶S/¶T)p в выражении dS = CVdT/T + (¶p/¶T)VdV и выражение для dV = (¶V/¶T)pdT + (¶V/¶p)Tdp = (¶V/¶T)pdT (p=const), имеем ((¶p/¶T)V(¶T/¶V)p(¶V/¶p)T = -1 или pbk/a = 1) cp – cV = T(¶p/¶T)V(¶V/¶T)p = pVTab = p2VTb2k = - T(¶p/¶T)V2(¶V/¶p)T ≥ 0.
СР - СV для твердых тел. В общем случае имеем: dQ = dU + pdV = cVdT + [(∂U/∂V)T + p]dV. При p = const Cp = (dQ/dT)p = CV + [(∂U/∂V)T + p](∂V/∂T)p. Используя равенство [(∂U/∂V)T + p] = T(∂p/∂T)V получим: Cp – CV = T(∂p/∂T)V(∂V/∂T)p. Cp – CV = TVa2K = TVoa2/b, где a - изобарический коэффициент объемного расширения a = (1/Vo)(¶V/¶T)p, K = -V(∂p/∂V)T = (1/a)(∂p/∂T)V - изотермический модуль всестороннего сжатия, b - коэффициент изотермической сжимаемости b = -(1/Vo)(¶V/¶p)T, Vo - молярный объем вещества при 0 К.
1.23. dS = (dU + SiAidai)/T = (1/T)(¶U/¶T)ai dT + (1/T)Si[(¶U/¶ai)ai, T + Ai]dai . Тогда (¶S/¶T)ai = (1/T)(¶U/¶T)ai, (¶S/¶ai)ai,T = (1/T)[(¶U/¶ai)ai, T + Ai]dai, i = 1, 2, 3, …, n, откуда, подобно 3.19, получаем следующие дифференциальное уравнение, связывающее термическое и калорическое уравнения состояния: T (¶Ai/¶T)ai = (¶U/¶ai)T + Ai 3.26 Для простой системы, подвергнувшейся действию силы всестороннего давления A = p, a = V , уравнение 3.26 имеет вид T(¶p/¶T)V = (¶U/¶V)T + p. 3.27 Первое начало для разности теплоемкостей Cp – CV дает выражение (2.7) : Cp – CV = [(¶U/¶V)T + p](¶V/¶T)p. Для вычисления Cp – CV по формуле 2.7 необходимо знать как термическое уравнение состояния p(T,V) , так и калорическое уравнение состояния U(T,V). Второе начало, устанавливая связь между этими уравнениями, позволяет найти Cp – CV , зная только одно термическое уравнение состояния. Действительно используя (3.27), находим: Cp – CV = T(¶p/¶T)V(¶V/¶T)p. Входящие сюда производные можно определить, зная лишь термическое уравнение состояния p =p(T,V) или измеряя непосредственно коэффициент объемного расширения a = (1/Vo)(¶V/¶T)p и коэффициент термического сжатия b = -(1/Vo)(¶V/¶p)T. Из тождества (см. задачу 1.7) (¶V/¶T)p(¶T/¶p)V(¶p/¶V)T = -1 и выражений для a и b находим: (¶p/¶T)V = -(¶V/¶T)p(¶p/¶V)T = a/b. Подставим эту производную в формулу 3.33 Cp – CV = VoTa2/b. 3.34 Так как, согласно условию устойчивости равновесного состояния всегда (¶V/¶p)T < 0 и, следовательно, b > 0, то из уравнения 3.34 находим, что Cp ≥ CV. Равенство выполняется при a = 0. Например, у воды при 4оС и нормальном атмосферном давлении, когда ее плотность максимальна и a изменяет знак: a < 0 при 0 < t < 4oC a > 0 при t > 4oC. Такое поведение коэффициентов объемного расширения у воды приводит к такому ее аномальному свойству, что в интервале температур 0 < t < 4оC при адиабатной сжатии она не нагревается, как другие жидкости и все газы, а охлаждается.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|



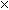 716,68 - 6
716,68 - 6  C.
C.