
|
|
Фотохимический смог в городской атмосфере
Понятие «смог» впервые было употреблено более 100 лет назад применительно к смеси дыма и тумана, обычно имевшей желтый цвет и образовывавшейся над Лондоном в периоды температурных инверсий. Позже его стали применять для характеристики условий задымления или тумана, наблюдаемых в атмосфере и других регионов. В настоящее время различают два основных вида смога: смог, связанный с загрязнением атмосферы копотью или дымом, содержащим диоксид серы (лондонский смог), и смог, вызванный загрязнением воздуха выхлопными газами транспорта, содержащими оксиды азота (смог Лос-Анджелеса). Для второго типа смога необходимой составной частью процесса его образования является протекание фотохимических реакций, поэтому его часто называют фотохимическим смогом. Среди особенностей фотохимического смога следует выделить следующие: 1) фотохимический смог образуется в ясную солнечную погоду при низкой влажности воздуха, причем максимальная концентрация вызывающих раздражение органов чувств веществ наблюдается вскоре после полудня; 2) химически он действует как окислитель (усиливает коррозию металлов, приводит к растрескиванию резины и т. д.); 3) фотохимический смог вызывает у людей сильное раздражение слизистой оболочки дыхательных путей и глаз, губит листву на деревьях; 4) в атмосфере наблюдается появление голубоватой дымки или беловатого тумана и связанное с этим ухудшение видимости. Одними из основных химических соединений, ответственных за ряд вышеперечисленных свойств смога, являются озон и пероксиацетилнитрат (ПАН).
 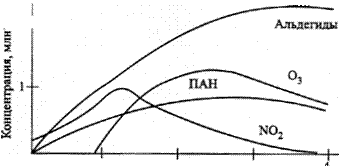
Рис. 7. Изменение концентрации примесей в атмосфере при облучении выхлопных газов автомобилей
Как показывают экспериментальные данные, увеличение концентрации озона в пробах воздуха, содержащих разбавленные выхлопные газы автомобилей, связано с характерным изменением относительного содержания оксидов азота (рисунок 7). Рост концентрации О3 в пробах воздуха начинается после того, как отношение концентраций NО2 и NО достигает максимума. Изменение концентрации озона в загрязненной городской атмосфере связано с процессами превращения оксидов азота. Образование и разрушение озона в тропосфере происходит, в частности, при протекании рассмотренных ранее реакций: NO2 + hv ® NO + О(3Р) (123) O(3P) + O2 + M ® M* + O3 (36) O3 + NO ® NO2 + O2 (45) В стационарных условиях скорости реакций разрушения и образования озона равны, поэтому можно записать: [O3] = k[NO2]/[NO], (128) где k – отношение константы скорости реакции фотодиссоциации NO2 к константе скорости реакции взаимодействия О3 и NO. Таким образом, концентрация озона в тропосфере будет возрастать при увеличении скорости конверсии NO в NO2. В атмосфере городов такое ускорение связано с наличием в воздухе органических соединений. Так, в случае окисления метана в присутствии оксидов азота цепочку превращений можно представить следующими реакциями: CH4 + OH· ® CH3 + H2O СН3 + О2 ® СН3ОО СН3ОО + NO ® СН3О + NO2 СН3О + О2 ® СН2О + НO2· НO2 + NO ® NO2 + ОН СН2О + OH ® Н2О + HCO HCO+O2 ® HO2 + CO HO2 + NO ® NO2 + OH CO + OH ® CO2 + H H + O2 ® HO2 HO2 + NO ® NO2 + OH NO2 + hv ® NO + O O + O2 + M ® O3 + M* Суммарная реакция: CH4 + 8O2 + 4M = CO2 + 2H2O + 4M*+ 4O3 (129) Таким образом, при полном окислении метана в присутствии оксидов азота на каждую молекулу метана в воздухе может образоваться до четырех молекул озона. С присутствием органических соединений в воздухе городов связаны и процессы образования высокотоксичных пероксидных соединений: R–C(O)–O–O–NO2 Наиболее распространенным пероксидным соединением, синтезирующимся в атмосфере, является пероксиацетилнитрат – первый член гомологического ряда, часто сокращенно называемый ПАН: СН3–С(O)–O–О–NO2. В случае присутствия в воздухе ароматических углеводородов возможно образование ароматических производных. Так, например, пероксибензоилнитрат, являющийся сильным слезоточивым газом, был идентифицирован в атмосфере Лос-Анджелеса наряду с пероксиацетилнитратом и его гомологами.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
