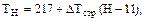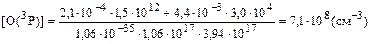|
|
Международные соглашения, направленные на сохранение озонового слоя
Продолжавшийся с середины и практически до конца прошлого века рост производства галогенпроизводных органических соединений привел к увеличению их концентрации в атмосфере. Так, только в период с 1970 по 1980 г. относительная концентрация таких озоноопасных соединений, как фреон-11 и фреон-12, возрастала в стратосфере в четыре и в три раза соответственно. Серьезную озабоченность вызывала и наблюдавшаяся в конце прошлого века тенденция уменьшения количества озона в стратосфере. Например, среднегодовое содержание озона за 18 лет (с 1969 по 1986 г.) снизилось в высоких широтах (53-64° с.ш.) на 2,3 ± 0,7%, в средних широтах (40-50° с.ш.) – на 3,8 ± 0,8% и на широтах 30-38° с.ш. – на 1,7 ± 0,7%. Необходимо отметить, что наибольшее отклонение, составившее 6,2 ± 1,5%, отмечено в высоких широтах в зимний период. Эти значения дают небольшой, но устойчивый тренд уменьшения содержания озона в атмосфере. Ежегодное уменьшение содержания озона в стратосфере в зимний период с 1969 по 1986 г. составляло примерно 0,3% при суммарных 6% за 18 лет. Серьезное беспокойство в мире вызвали сообщения об уменьшении содержания озона над Антарктидой. Поскольку основной причиной этого явления считались хлорфторуглеводороды, мировое сообщество предприняло объединенные усилия, направленные на уменьшение производства и выброса в атмосферу озоноразрушающих веществ. Первым международным актом, ограничивающим производство фреонов и других разрушающих озоновый слой соединений, стал Монреальский протокол. Он был подписан тридцатью странами в 1987 г. и вступил в силу с 1 января 1989 г. Основными положениями Монреальского протокола были определены следующие действия, которые обязались предпринять подписавшие его страны: 1) производство фреонов 11, 12, 11З, 114, 115 - заморозить на уровне 1986 г. начиная с 1992 г.; - сократить до 80% от уровня 1986 г. начиная с 1993 г.; - сократить до 50% от уровня 1986 г. начиная с 1998 г.; 2) производство галонов (бронированных галогеналканов для тушения пожаров) ограничить на уровне 1986 г. В 1989 г. Совет министров Европейского сообщества объявил, что производство фреонов будет полностью прекращено к 2000 г. США сделали аналогичное заявление. Годом позже страны, подписавшие Монреальский протокол (их стало более 60), одобрили эту политику. В 1990 г. Монреальский протокол был вновь пересмотрен. Страны, его подписавшие, взяли на себя следующие обязательства: 1) производство фреонов - сократить до 50% начиная с 1995 г., - сократить до 15% начиная с 1997г., - прекратить полностью к 2000г.; 2) производство тетрахлорметана (четыреххлористого углерода, используемого в качестве растворителя) - сократить до 15% начиная с 1995г., - прекратить полностью к 2000г.; 3) производство галонов прекратить к 2000 г. (за исключением соединений, для которых не известны альтернативные заменители); 4) производство 1,1,1-трихлорэтана (используемого в качестве растворителя) - сократить до 70% начиная с 1995 г., - сократить до 30% начиная с 1997 г., - прекратить полностью к 2005 г. Необходимо отметить, что Монреальский протокол, являющийся первым примером коллективного мирового сотрудничества в решении глобальных проблем, в настоящее время успешно выполняется.
Примеры решения задач
Пример 19.Оцените, во сколько раз скорость связывания атомарного кислорода в реакции синтеза озона выше, чем в реакции разрушения озона, когда эти процессы протекают при нормальном атмосферном давлении у поверхности Земли. Концентрация озона в приземном воздухе составляет 4 . 1011см-3. Константа скорости реакции образования озона kобр = 6,9 . 10–34см6 . с–1, если третье тело – молекулы кислорода. Константа скорости процесса разрушения озона при взаимодействии с атомарным кислородом kгиб = 8,4 . 10–15 см3 . с–1. Решение.Процессы образования и гибели озона в реакциях связыва-ния атомарного кислорода можно представить следующими уравнениями: O(3P) + O2 + M ® O3 + M* (1) O(3P) + O3 ® O3 + 2O2 (2) где О(3Р) – атомы кислорода в невозбужденном состоянии; М – третье тело, участвующее в реакции образования озона. Скорости процессов образования и гибели озона по реакциям (1) и (2) можно выразить уравнениями: uобр = kобр[O(3P)][O2][M] uгиб = kгиб[O(3P)][O3] Отношение скоростей реакций образования и гибели озона можно определить как
В случае, когда третье тело в процессе образования озона – молекулы кислорода ([О2] = [М]), отношение скоростей реакций (1) и (2) составит:
Таким образом, для решения задачи необходимо найти содержание молекул кислорода в кубическом сантиметре воздуха. Среднее значение температуры приземного воздуха соответствует средней температуре нижней границы тропосферы и равно 15°С (таблица 2). При нормальном атмосферном давлении концентрация молекул кислорода составит (пример 18): N = 6,02 . 1023 . 273 . 0,2095/(22,4 . 103 . 288) = 5,34 . 1018 (см –3). Отношение скоростей реакций (1.1) и (1.2) составит:
Ответ: скорость связывания атомарного кислорода в реакции образования озона в 5,9 . 106 раз больше, чем в реакции гибели озона.
Пример 20. Определите концентрацию атомарного кислорода в состоянии О(3Р) на высоте 20 км при условии динамического равновесия между процессами его образования (при фотолизе озона и диоксида азота) и стока (при образовании озона). Концентрации озона и диоксида азота составляют: [О3] = 1,5 . 1012см –3, [NО2] = 3 . 104 см –3. Коэффициенты фотодиссоциации озона и диоксида азота на высоте 20 км равны: J(O3) = 2,1 . 10–4 . c–1; J(NO2) = 4,4 . 10–3 . с–1. Константа скорости реакции образования озона в случае, когда третьим телом являются молекулы азота, определяется по уравнению: k = 6,2 . 10–34(T/300)–2(см6 . с–1), где Т – температура реакции. Решение. Представим процесс образования атомарного кислорода в виде уравнений реакций: O3 + hv ® O2 + O(3P) (1) NO2 + hv ® NO + O(3P) (2) Скорости процессов фотохимического разложения озона и диоксида азота можно выразить соотношениями: u1 = J(O3) . [O3] (3) u2 = J(NO2) . [NO2] (4) Скорость образования атомарного кислорода в О(3Р) состоянии будет численно равна сумме скоростей процессов фотолиза О3 и NО2, поскольку по условию задачи другие источники поступления О(3Р) не принимаются во внимание и в процессе фотохимического разложения по реакциям (1) и (2) на каждую молекулу озона и диоксида азота образуется один атом кислорода. Поэтому можно записать: uобр = u1 + u2 (5) Процесс стока атомарного кислорода по условию задачи связан только с образованием молекул озона: О2 + О(3Р) + М ® O3 +M* (6) Скорость этой реакции можно представить уравнением: ucт = k[O2][O(3Р)][М], (7) где k – константа скорости реакции образования озона; [М] – концентрация третьего тела, в рассматриваемом случае – концентрация азота на высоте 20 км. В условиях динамического равновесия скорости процессов образования и стока атомарного кислорода численно равны: uобр = uст u1 + u2 = ucт J(O3) . [O3]+ J(NO2) . [NO2] = k[O2]O(3P)][M] (8) Из полученного уравнения можно выразить концентрацию атомарного кислорода: Таким образом, для решения задачи следует определить значения концентраций всех компонентов и констант и выразить их в одинаковых единицах измерения. Определим температуру на высоте 20 км. Ее значение необходимо для расчета концентраций азота и определения константы скорости реакции образования озона на данной высоте. Эта область находится в стратосфере (таблица 2), и температуру можно определить по уравнению:
где 217 – температура нижней границы стратосферы, К; H – высота в стратосфере, для которой определяется температура, км; 11 – высота нижней границы стратосферы, км; DTстр – температурный градиент, в стратосфере он равен 1,38 К/км; T20 = 217 + 1,38(20 – 11) = 229 (К) Для определения количества молекул азота на высоте 20 км необходимо рассчитать количество молекул воздуха на данной высоте (пример 18): nвозд = 2,55 . 1019 ехр[–29 . 10 –3 . 9,8 . 20000/ (8,31 . 229)] = 5,04 . 1017(см –3) Поскольку в атмосферномвоздухе соотношение основных компонентов до высоты 100км практически не меняется, концентрация молекул азота на высоте 20 км будет равна: [N2] = 5,04 . 1017 . 78,08 . 10–2 = 3,94 . 1017 (см –3) Концентрация молекулярного кислорода на высоте 20км составит: [O2] =5,04 . 1017 . 20,95 . 10–2 = 1,06 . 1017(см –3) Константа скорости реакции образования озона на высоте 20 км равна: k = 6,2 . 10–34(T/300)–2 = 6,2 . 10–34229/300)–2 = 1,06 . 10–35 (см6 . с–1) Концентрация атомарного кислорода составит:
Ответ: концентрация атомарного кислорода составит 7,1 . 108 см –3. Пример 21. Какой из фреонов – Ф-11 или Ф-152 – представляет большую опасность для озонового слоя планеты? Решение.Для ответа на поставленный вопрос следует прежде всего представить молекулярные формулы хлорфторуглеводородов, отвечающие фреонам Ф-11 и Ф-152. В соответствии с системой, разработанной специалистами фирмы «Дюпон» и получившей широкое распространение, при классификации фреонов цифрами обозначается разность между числом, в котором записанные подряд цифры означают количество атомов углерода, водорода и фтора в молекулярной формуле хлорфторуглеводорода. и некоторым «кодовым» числом, которое равно 90. Например, запись Ф-11 будет означать: 11 + 90 = 101, т.е. в состав соединения входят 1 атом углерода, О атомов водорода и 1 атом фтора. Поскольку углерод в органических соединениях всегда имеет валентность, равную 4, в состав молекулы фреона Ф-11 должно входить 3 атома хлора. Поэтому молекулярная формула Ф-11 отвечает соединению СFСl3. В случае фреона Ф-152 имеем: 152 + 90 ~ 242, т.е. в состав фторхлоруглеводорода входят 2 атома углерода, 4 атома водорода и 2 атома фтора. Атомы углерода в хлорфторуглеводородах, если это не оговаривается особо, связаны между собой одинарной связью, поэтому в данном соединении может быть только 6 неуглеродных атомов. Все «вакантные» места заняты атомами водорода и фтора, поэтому в этом фреоне нет атомов хлора. Его молекулярная формула имеет вид С2Н4F2. Поскольку фреон Ф-152 не содержит хлора, он не представляет опасности для озонового слоя. Однако в результате его трансформации в тропосфере возможно образование соединений, токсичных для биоты. Ответ: фреон Ф-11, содержащий три атома хлора в каждой молекуле, представляет большую опасность для озонового слоя, чем фреон Ф-152, молекулы которого не содержат хлора. Пример 22. Какой из фреонов – СF2Сl2 или СНF2Сl – более опасен для озонового слоя? Представьте кодовые формулы соответствующих фреонов. Решение. Поскольку молекулы дифторхлорметана в отличие от молекул дифтордихлорметана содержат в своем составе атомы водорода, они будут менее устойчивы в тропосфере. Время их жизни в атмосфере значительно меньше, чем у молекул СF2Сl2. Они будут разлагаться, не достигая озонового слоя. Поэтому большую опасность для озонового слоя представляют молекулы дифтордихлорметана. Зная условия кодирования (пример 21), для дифтордихлорметана можно записать: СF2С12 или СН0F2С12 - 102; 102 – 90 = 12, следовательно, это фреон Ф-12. Для дифторхлорметана имеем: СНF2С1 - 112; 112 – 90 = 22, следовательно, это фреон Ф-22. Ответ:хлорфторуглеводороды СF2С12 и СНF2Сl – это фреоны Ф-12 и Ф-22 соответственно. Большую опасность для озонового слоя представляют молекулы дифтордихлорметана (Ф-12).

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
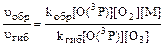

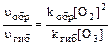
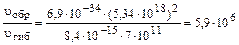
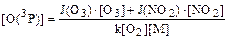 (9)
(9)