
|
|
Карбонатное равновесие в океане
Неорганические соединения углерода в морской воде представлены, как и в случае пресных поверхностных и глубинных вод, диоксидом углерода и ионами НСО Таблица 5. Коэффициенты активности ионов НСО
Для воды океана величина ионной силы может быть определена как функция хлорности: I = 0,0147 +0,03592 . С1%о+ 0,000068 . (С1%о)2, (45) где I – ионная сила раствора; Cl%o –величина хлорности воды в промилле. При расчетах карбонатных равновесий для морской воды следует использовать данные об активности ионов. Коэффициенты активности ионов НСО
где К1 и К2 – термодинамические константы диссоциации. В отличие от термодинамических констант, смешанные константы диссоциации угольной кислоты зависят от солености и хлорности морской воды. Их использование позволяет избежать необходимости введения коэффициентов активности, так как они уже учтены при экспериментальном определении констант. При различных хлорности и температуре воды значения констант диссоциации угольной кислоты по первой и второй ступеням могут быть найдены, например, по уравнениям:
Протекание процессом растворения или осаждения СаСО3 в рассматриваемой карбонатной системе океана зависит, помимо парциального давления СO2 и температуры, от солености воды и величины гидростатического давления. В океанах создается весьма неоднородное распределение насыщенности воды карбонатом кальция; по глубине обычно выделяют четыре зоны с различной степенью насыщения воды карбонатами. Первая зона – поверхностный слой воды до глубины 300-800 м – значительно пересыщена. Этому способствуют сравнительно высокие температуры и низкие парциальные давления диоксида углерода. Вторая зона охватывает слой глубиной до 1500-2000 м. В связи с интенсификацией процесса окисления органического вещества в этой зоне происходит увеличение Рсо2 и может возникнуть недонасыщение карбонатом кальция. Третья зона (до 3500-4500 м) отличается состоянием, близким к равновесному. Четвертая зона (от 3500-4500 м до дна) характеризуется ярко выраженным недонасыщением воды карбонатом кальция, связанным с ростом гидростатического давления.
Щелочность природных вод
Одной из важнейших особенностей большинства природных вод является способность нейтрализовать ионы водорода. Эта способность называется щелочностьюводы и определяется экспериментально при титровании пробы воды сильной кислотой, обычно НС1, в присутствии фенолфталеина (рН перехода окраски – 8,3) и затем метилоранжа (рН перехода окраски – 4,5). Основными компонентами, ответственными за процессы связывания ионов водорода, в большинстве природных вод являются ионы НСО Основные химические реакции, протекающие в водоеме при нейтрализации ионов водорода, можно представить следующими уравнениями:
При экспериментальном определении щелочности на первом этапе (до рН перехода 8,3) связываются все ионы гидроксила, и практически все ионы карбоната переходят в НСО Щ = [НСО где Щ – общая щелочность воды, моль/л. Если рН водной пробы еще до титрования ниже 4,5, то о такой воде говорят как о воде с нулевой щелочностью. Необходимо четко представлять себе разницу между основностью и щелочностью раствора. Основностьраствора характеризует лишь концентрацию ионов гидроксила в данный момент времени. Щелочностьже показывает как бы резервную емкость воды, способность нейтрализовать определенное количество ионов водорода. Так, например, раствор, содержащий 0,001 моль/л NaOH, будет иметь рН 11 и общую щелочность, равную концентрации ОН-ионов: Щ = 0,001 моль/л. В то же время раствор, содержащий 0,1 моль/л NaНСО3 будет иметь более низкое значение рН (рН 8,3), но его щелочность, которая будет определяться в основном концентрацией гидрокарбонат-ионов, будет в 100 раз больше, чем у раствора NaOH с концентрацией 0,001 моль/л. Величина щелочности природных под имеет большое значение и с точки зрения фотосинтеза, протекающего в водоемах. В упрощенном виде процесс фотосинтеза может быть представлен следующим образом: СО2(p-p) + H2O НСО Следовательно, при связывании углерода и синтезе органических соединений в случае отсутствия дополнительного поступления диоксида углерода возрастает рН раствора, а количество синтезируемых органических соединений зависит от содержания СО2 и НСО Иногда и природных водоемах в связи с бурным протеканием процессов фотосинтеза и недостаточной скоростью поступления диоксида углерода рН поднимается до 10 и выше. Такие высокие значения рН, как и закисление, отрицательно сказываются на развитии водных экосистем. Поскольку, как отмечалось выше, для поверхностных водоемом, находящихся в равновесии с карбонатом кальция (кальцитом) и диоксидом углерода, содержащимся п атмосферном воздухе, рН воды должен составлять 7,3-8,4, значение щелочности в этих водоемах будут определяться лишь концентрацией гидрокарбонат-ионов (распределительная диаграмма на рисунке 2). Концентрация НСО Следует отметить, что при отсутствии процессов растворения или осаждения щелочность воды остается неизменной. При изменении рН среды происходят лишь взаимные трансформации компонентов карбонатной системы. Поэтому щелочность часто называют «консервативной величиной».

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
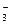 и СО
и СО 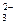 . Химические превращения, связывающие между собой отдельные компоненты карбонатной системы, едины для воды океана и пресноводных водоемов. Однако в отличие от пресных водных систем вода океанов представляет собой многокомпонентный раствор электролитов средней концентрации, который характеризуется высокими значениями ионной силы
. Химические превращения, связывающие между собой отдельные компоненты карбонатной системы, едины для воды океана и пресноводных водоемов. Однако в отличие от пресных водных систем вода океанов представляет собой многокомпонентный раствор электролитов средней концентрации, который характеризуется высокими значениями ионной силы ;(46)
;(46) ,(47)
,(47)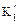 и
и  – смешанные константы диссоциации;
– смешанные константы диссоциации;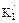 = 6,3784 – 0,01137 . Сl%0 – 0,010765Т+ 1,563 . 10–4T2; (48)
= 6,3784 – 0,01137 . Сl%0 – 0,010765Т+ 1,563 . 10–4T2; (48)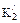 = 9,8227 – 0,2719 . С1%о– 0,015215T + 1,3232 . 10–4T2. (49)
= 9,8227 – 0,2719 . С1%о– 0,015215T + 1,3232 . 10–4T2. (49) НСО
НСО  СО
СО  (54)
(54) (55)
(55)