
|
|
I. Характеристика водорода, исходя из его положения в периодической системе.12 ЛЕКЦИЯ №21
Водород. Вода. Элементы IА-группы периодической системы Д.И. Менделеева.
План 1. Водород. Вода. 2. Щелочные металлы: 1) положение в периодической системе 2) нахождение в природе 3) получение 4) физические свойства 5) химические свойства 6) важнейшие соединения и применение.
ВОДОРОД И ЕГО СОЕДИНЕНИЯ. I. Характеристика водорода, исходя из его положения в периодической системе.
+1 Н ) 1s I 1е-
1 1p = 1 + 0n = 0 H = -------------------- 1 ē = 1
Степени окисления: + 1; 0; -1.
II. Физические свойства:
Водород открыт в 1776 году английским химиком Кэвендишем.
Это газ, легче воздуха, молекула двухатомная, без цвета, без запаха. Малорастворим в воде. При - 252,8°С переходит в жидкое состояние. Жидкий водород бесцветен.
Существует три изотопа водорода: 1. Протий Ar = I; 2. Дейтерий Ar = 2; 3. Тритий Ar =3.
III. Распространение в природе:
В земной коре - 0,150 % от массы, с учетом гидросферы – 1%, в атомных процентах 15,6 %. По распространенности водород занимает третье место после кислорода и кремния.
IV. Получение:
1. Zn + 2НСl ® ZnCl2 + Н2 в аппарате Fe + Н2SO4 ® Fe SO4 + Н2 Киппа 2. Электролизом воды:
(катод) (анод) (р-р) 3. 2Na +2 Н2О ® 2 NaOH + Н2 Ca +2 Н2О ® Ca(OH)2+ Н2
б) В промышленности: Электролиз водных растворов KCl, NaCl, как рабочий продукт. 1. (катод) (анод) (р-р) 2. Конверсионный способ (конверсия превращения), получают этим способом 50% водорода. Получают сначала водяной газ, а затем водород
пар водяной газ t°, k= Fe2O3
водян.газ. пар
3. Конверсия метана с водяным паром: Nit 1300°C
пар 4. Разложение метана:
5. Глубоким охлаждением коксового газа (-196°С): Все газы при такой температур конденсируются, кроме Н2.
V. Химические свойства:
1. Водород может образовывать газообразные соединения состава RH4, RH3, RH2, RH. При высокой температуре водород соединяется со щелочными и щелочно-земельными металлами, образуя гидриды металлов (LiH, NaH, KH, CaН2.)
Гидриды металлов – белые кристаллические вещества. Гидриды металлов разлагаются водой с образованием щелочи и водорода: Ca Н2 +2 Н2О ® Са (ОН) 2 + 2H2
2. Взаимодействие с кислородом:
3. Водород восстанавливает металлы из их оксидов:
VI. Важнейшие соединения: Важнейшим соединением водорода является ВОДА (H2O). Вода прозрачна, без запаха, без вкуса, плотность равна 1г/см3(при t- 4oC), может быть в трех агрегатных состояниях: 1. Твердое вещество, жидкая вода переходит в твердое состояние при t = 0oC 2. Жидкость 3. Газообразное состояние (пар) Вода плохо проводит тепло и электрический ток, хороший растворитель. Молекула воды имеет угловую форму, атомы водорода по отношению к кислороду образуют угол = 104,5o. Вода – диполь. В жидкой воде вместе с обычными молекулами существуют ассоциированные молекулы, связанные между собой водородными связями: (H2O)×n Вода бывает гигроскопическая. Это вода, содержащаяся в порах и смачивающая многие вещества с поверхности. Вещества с повышенной способностью притягивать воду (влагу) называются гигроскопическими. Минеральная вода - вода, содержащая в I л более 1г растворенных минеральных веществ.
Способы очистки воды: 1. Фильтрование– освобождение воды от механических примесей при пропускании через мелкопористый материал. В качестве фильтра используют: вату, фильтровальную бумагу, ткани, активированный уголь, смесь песка и гравия. 2. Дистилляция (перегонка). Этот вид очистки воды проводят в дистилляторах. В них воду превращают в пар, затем конденсируют в холодильнике и в приемнике собирается чистая вода. Примеси остаются в перегонной колбе.
Хлорирование – это обеззараживание воды.
Жесткость воды:
Общая жесткость воды обусловлена присутствием в ней катионов Mg2+ и Са2+, анионов НСО3- и SO42- . В жесткой воде мыло не пенится, плохо развариваются овощи, ухудшается качество тканей, в котлах много накипи…
Жесткость бывает: 1. Временная (гидрокарбонатная) – этот вид жесткости устраняется, как правило кипячением. Обусловлена эта жесткость присутствием катионов Mg2+ ,Са2+ и анионом НСО3-
Ее можно устранить также химическим путем: Ca(HCO3)2 + Ca(ОН) 2 ® 2 Ca CO3¯ + 2 H2O Известковая Вода
2. Постоянная жесткость - жесткость, обусловленная присутствием ионов Mg2+ , Ca2+ и SO42- и её нельзя устранить при кипячении.
Ее можно устранить химическим путем: CaSO4 + Na2 CO3 ® Ca CO3¯ + Na2 SO4 Устранить жесткость воды можно также при помощи катионитов и анионитов. Катиониты и аниониты называют по-другому иониты. Катиониты - это иониты (ионно-обменные смолы), которые могут обменивать свои катионы на катионы среды. Аниониты – это иониты, которые могут обменивать свои анионы на анионы среды. Если пропустить воду через слои катионита, то катионы (чаще всего это соединения содержащие катионы натрия) будут обмениваться на ионы Ca2+ и Mg2+, содержащиеся в воде. Жесткость при этом устраняется. Na2R + Ca2+ ® 2 Na+ + Ca R Катионит Na2R + Mg2+ ® 2 Na+ + Mg R В качестве катионов можно использовать ионно-обменные смолы и алюмосиликаты: 1. пермутит NaAlSiO4 2NaAlSiO4 + CaSO4® Ca(AlSiO4) 2 + Na2SO4 2. ионно-обменная смола : Na2[ Al2Si2O8•H2O] Если катиониты, содержащие катионы Ca2+, Mg2+ (MgR,Ca R) выдержат в растворе NaCl, то катионы Na+ замещают катионы Ca2+ и Mg2+ и регенированный катионит можно снова использовать для смягчения воды. CaR + 2Na+ ® Na2R + Ca2+ MgR +2Na+ ® Na2R + Mg2+
По значению жесткости природную воду различают: 1. очень мягкая 2. мягкая 3. средней жесткости 4. жесткая 5. очень жесткая Химические свойства воды: Вода взаимодействует: 1. с металлами Ca + 2H2O ® Ca(OH) 2 + Н2 2Li + 2H2O ® 2LiOH + Н2 2. с неметаллами: H2O + CI2 ® HCIO + HCI 3. с оксидами: а) с основными оксидами: Na2O + H2 O ® 2NaOH б) с кислотными оксидами: 1. CO2 + H2O Û H2 CO3 2. SO2 + H2 O Û H2 SO3 3. SO3 + H2 O ® H2 SO4 4. с основаниями: NaOH + H2 O ® NaOH·H2 O + Q 5. с кислотами: H2 SO4+ 2H2O® H2 SO4·2H2O+ Q конц. 6. с солями, образуя кристаллогидраты: а) 10 H2 O + Na2 СO3 ® Na2 СO3·10 H2 O б) 5 H2 O + СuSO4 ® СuSO4·5 H2 O Кристаллизационная вода – вода, входящая в состав кристаллов. Кристаллогидраты – это вещества, содержащие кристаллизационную воду. 7. гидролиз солей: Na2CO3 + H2O « NaOH + NaHCO3
Тяжелая вода – это вода, содержащая в своем составе изотопы: дейтерий и тритий. С тяжелой водой реакции протекают медленнее, ее применяют в качестве замедлителя нейтронов в ядерных реакциях. VII. Применение водорода и его соединений: 1. Для наполнения аэростатов и дирижаблей в смеси с гелием. 2. Водородно-кислородным пламенем режут и сваривают металлы. 3. Используют для получения редких металлов, как восстановитель.
4. Используют для получения аммиака, из которого в свою очередь получают НNO3 и азотные удобрения. 5. В органическом синтезе водород используют в реакциях гидрирования. Гидрирование это присоединение водорода. 6. Дейтерий и тритий применяют в атомной энергетике, как термоядерное горючее. 7. Водород используется для синтеза соляной кислоты: H2 + CI2 ® 2HCI 8. Вода используется как растворитель Без H2O не возможна жизнь. В живых организмах воды » 63% по весу. Медузы и водоросли содержат до 90 % воды. Без воды человек может обойтись не более 3-4 суток.

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 а) В лаборатории:
а) В лаборатории: 2Н2О + NaOH эл. ток O2 + 2Н2 + NaOH
2Н2О + NaOH эл. ток O2 + 2Н2 + NaOH 2 KCl + 2 Н2О эл. ток Н2 + Сl2 + 2KOH
2 KCl + 2 Н2О эл. ток Н2 + Сl2 + 2KOH
 а) C + Н2О t I000 ° C CO + Н2 ;
а) C + Н2О t I000 ° C CO + Н2 ;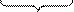
 б) CO + Н2 + Н2О 400 - 450°С СО2 + 2 Н2
б) CO + Н2 + Н2О 400 - 450°С СО2 + 2 Н2  CH4 + 2Н2О СО2 + 4Н2
CH4 + 2Н2О СО2 + 4Н2  CH4 t=350°C, K=Fe, Na C + 2Н2
CH4 t=350°C, K=Fe, Na C + 2Н2 Ca + Н2 t CaН2 ;
Ca + Н2 t CaН2 ;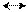 2Н2 + О2 t 2Н2О
2Н2 + О2 t 2Н2О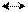 CuO + H2 t H2O + Cu¯
CuO + H2 t H2O + Cu¯ Ca(HCO3)2 t Ca CO3¯ + СО2 + H2O
Ca(HCO3)2 t Ca CO3¯ + СО2 + H2O Мg(HCO3)2 t Мg CO3¯ + СО2 + H2O
Мg(HCO3)2 t Мg CO3¯ + СО2 + H2O MoO3 + 3H2 t Mo + 3H2O
MoO3 + 3H2 t Mo + 3H2O