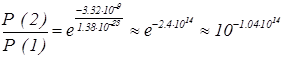|
|
Изотермическая атмосфера. Распределение молекул по высоте12 Механическое равновесие в атмосфере
Рассмотрим механическое равновесие столба воздуха. На высоте h выделим тонкий слой толщиной Dh. В состоянии покоя слой удерживается равновесием сил. Пусть m – масса одной молекулы, n(h) – число молекул в единице объема на высоте h. Объем слоя равен
Силу тяжести уравновешивает разность сил давления P, действующих на нижнюю и верхнюю границы слоя. Снизу сила давления равна
или
При
Основное уравнение молекулярно-кинетической теории –
Подставляя (6) в (5), получим
В уравнении (7) неизвестным является целая функция n(h). Такого рода уравнения называются дифференциальными уравнениями. Данное уравнение можно решить. Преобразуем его:
Соотношение (8) между dn и dh выполняется на любой высоте, поэтому суммы по всем слоям от нуля до h левых и правых частей будут равны между собой
Сумма вида левой части уравнения (9) равна
Суммирование правой части дает
В итоге имеем:
Или
На нулевой высоте имеем n(h)=n(0). Если опять вернуться к основному уравнению молекулярно-кинетической теории (5), то уравнение (12) можно переписать для давления:
Обсуждение вероятностного смысла барометрической формулы Статистическое определение вероятности В повседневной жизни мы используем представления о вероятности, которые опираются на вполне здравые рассуждения. Поясню их на примере. Пусть в мешке N одинаковых шариков. Из них N1 белых и N2 черных. Наугад, не подглядывая, мы вытаскиваем один шар. Естественно предположение, что вероятность вытаскивания белого шара равна Барометрическая формула В разделе 1 мы получили такой результат: плотность числа молекул на высоте h равна Из выражения (16) видно, что более вероятно молекуле находиться на нулевом уровне. Менее вероятно молекуле находиться на высоте h. Обращаем внимание, величина mgh, стоящая в числителе дроби в показателе экспоненты, это потенциальная энергия молекулы в поле тяжести Земли, которую она приобрела в результате случайного теплового обмена энергиями с прочими молекулами. Величина полученной потенциальной энергии является не результатом одноактной передачи, а результатом растянутого во времени процесса. Молекула попала на высоту h после большого числа столкновений. Коллектив молекул постепенно передал необходимое количество тепловой энергии. Можно утверждать, что –mgh/T – уменьшение энтропии всех молекул атмосферы за счет передаче тепла Q=mgh одной молекуле. Это важное наблюдение – термодинамическая система самопроизвольно может перейти из более вероятного в менее вероятное состояние за счет случайного приобретения тепловой энергии. При этом формулу (16) можно переписать следующим образом: В свое время Больцман доказал, что данное соотношение (18), полученное нами при анализе равновесного состояния молекул в поле тяжести, справедливо для любой термодинамической системы. Например, с помощью формулы (18) мы можем рассчитывать вероятности флуктуаций плотности молекул в состоянии теплового равновесия. Задача 1. Во сколько раз вероятность того, что в кубическом сантиметре окажется на 0,001% меньше молекул, чем в равновесном состоянии при давлении 105 Па и температуре 300 К? Решение. Воспользуемся формулами (17) или (18). Надо найти отношение вероятности быть в состоянии с избыточной концентрацией к вероятности быть с равновесной концентрацией в заданном объеме 1 см3. Для этого требуется найти разность энтропий данных двух состояний. Воспользуемся тем, что энтропия является функцией состояния. Данное свойство энтропии позволяет рассчитать разность энтропий двух состояний как изменение энтропии в каком-либо известном переходе из состояния с равновесной концентрацией в состояние с повышенной концентрацией. Пусть газ находится в равновесном состоянии с концентрацией n0, которую можно найти из основного уравнения молекулярно-кинетической теории:
Выделим в газе объем, равный V0(1+10-5), где V0=1 см3. Далее изотермически сожмем его до объема V0. Работа, которую надо совершить при этом как раз равняется необходимому количеству теплоты, переданного от остального газа данной порции. Она равна
Таким образом, необходимое количество теплоты равно
соответствующее изменение энтропии
Не смотря на то, что найденное изменение энтропии – малая величина, в конечном выражении отношения вероятностей она делится на постоянную Больцмана, еще гораздо меньшую величину. Таким образом, получаем
как видно, это отношение чудовищно мало. Оказалось, что даже такие сравнительно небольшие флуктуации, практически, невозможны. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Для упрощения математического анализа введем следующую модель атмосферы, окружающей Землю. Молекулы атмосферы удерживаются силой тяжести, температура воздуха на любой высоте одна и та же.
Для упрощения математического анализа введем следующую модель атмосферы, окружающей Землю. Молекулы атмосферы удерживаются силой тяжести, температура воздуха на любой высоте одна и та же. . В слое содержится
. В слое содержится 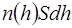 штук молекул (S – площадь сечения столба). На молекулы слоя вертикально вниз действует сила тяжести, равная
штук молекул (S – площадь сечения столба). На молекулы слоя вертикально вниз действует сила тяжести, равная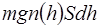 (2)
(2) , сверху –
, сверху – 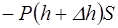 . Условие равновесия слоя
. Условие равновесия слоя (3)
(3) (4)
(4) правая часть представляет собой производную от давления по высоте, поэтому уравнение (4) можно переписать более стандартно:
правая часть представляет собой производную от давления по высоте, поэтому уравнение (4) можно переписать более стандартно: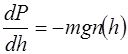 (5)
(5)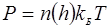 (6)
(6) (7)
(7) (8)
(8)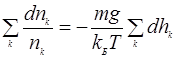 (9)
(9)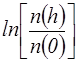 (10)
(10)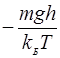 (11)
(11)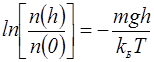
 (12)
(12) (13)
(13)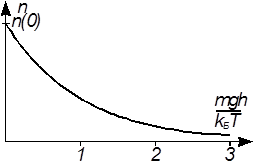 Параметр
Параметр 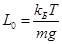 имеет размерность длины. Он называется шкалой высоты для данного газа (масса молекулы которого равна m). Он равен высоте, на которой концентрация молекул в eраз меньше, чем на нулевом уровне. Шкала высоты водорода в 16 раз больше шкалы высоты кислорода. Формула (12) или (13) называется барометрической формулой. Формула (12) описывает распределение плотности молекул по высоте. С ростом высоты плотность экспоненциально уменьшается
имеет размерность длины. Он называется шкалой высоты для данного газа (масса молекулы которого равна m). Он равен высоте, на которой концентрация молекул в eраз меньше, чем на нулевом уровне. Шкала высоты водорода в 16 раз больше шкалы высоты кислорода. Формула (12) или (13) называется барометрической формулой. Формула (12) описывает распределение плотности молекул по высоте. С ростом высоты плотность экспоненциально уменьшается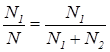 , а вероятность вытаскивания черного шара равна
, а вероятность вытаскивания черного шара равна  . Соображения опираются, кажется, на очевидное утверждение: вероятность какого-либо события равна отношению числа благоприятных исходов к полному числу возможных исходов. Это рассуждение лежит в основе экспериментального определения вероятности в статистике.
. Соображения опираются, кажется, на очевидное утверждение: вероятность какого-либо события равна отношению числа благоприятных исходов к полному числу возможных исходов. Это рассуждение лежит в основе экспериментального определения вероятности в статистике. , (14)
, (14) , (15)
, (15) , (16)
, (16) , (17)
, (17) 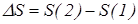 , то отношение вероятностей застать систему в том или ином состоянии равно
, то отношение вероятностей застать систему в том или ином состоянии равно  (18)
(18) (19)
(19)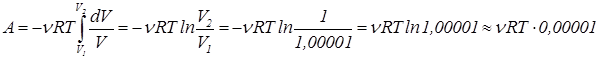 . Число молей в заданном объеме можно определить из уравнения состояния
. Число молей в заданном объеме можно определить из уравнения состояния (20)
(20) (21)
(21)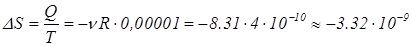 (22)
(22)