|
|
Гилберт С. Биология развития: В 3-х т. Т. 3: Пер. с англ. – М.: Мир, 1995. – 352с.ПРОСТРАНСТВЕННАЯ УПОРЯДОЧЕННОСТЬ КЛЕТОК 41
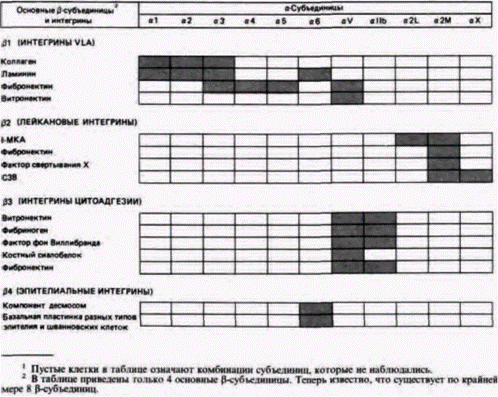
часто связывает более, чем одну молекулу, и его специфичность определяется клеточным окружением. Например, интегрин α2β1 способен связывать и коллаген, и ламинин. На одних клетках он действительно связывается обеими молекулами, но на других тот же самый интегрин связывается либо с ламинином, либо с коллагеном. В некоторых случаях предпочтение того или иного субстрата объясняется ионными условиями. Часто в одном и том же органе можно встретить различные интегрины. Так, например, клетки почечных канальцев происходят из агрегата мезенхимных клеток. Однако по мере развития клетки, дающие начало эпителию боуменовой капсулы, экспрессируют интегрин а3β1, тогда как все клетки канальца экспрессируют интегрин α6β1. Связывание А-цепи ламинина интегрином α6β1, по-видимому, имеет существенное значение для формирования поляризованного эпителия почечных канальцев (Korhonen et al., 1990; Sorokin et al., 1990). Значение интегринов для морфогенеза очень ярко иллюстрирует пример, относящийся к развитию дрозофилы. Как и интегрины позвоночных, интегрины дрозофилы состоят из двух субъединиц (α и β), пронизывающих клеточную мембрану. У двух известных интегринов дрозофилы β-субъединицы идентичны, а α-субъединицы различаются. Оба этих интегрина действуют на тканевую и клеточную адгезию во время развития совместно. При развитии крыла приводятся в контакт два эпителиальных слоя. При этом интегрин PS1 обнаруживается на базальной поверхности презумптивного дорсального эпителия крыла, тогда как интегрин PS2 находится на верхней поверхности презумптивного вентрального эпителия крыла. В процессе метаморфоза и тот и другой эпителий встречаются и слипаются, формируя двуслойную пластинку крыла. Мутации в интегринах приводят к тому, что в некоторых участках крыло расслаивается, о чем свидетельствуют пузырьки между двумя пластинками (Wilcox et al., 1989; Brower, Jaffe, 1989). Поскольку интегрины необходимы для прикрепления мышц к эпидермису и к стенке кишки, некоторые мутации, приводящие к синтезу аномальных интегринов, летальны. В случае летальной мутации lethal (1) myospheroid наблюдается недостаток генов, кодирующих β-субъединицу интегринов дрозофилы. Без этой субъединицы интегрины не образуются. Соматические мышцы, сокращаясь, становятся шарообразными и не прикрепляются к стенке тела или кишке (Leptin et al., 1989). Если для связывания молекул внеклеточного мат-
Гилберт С. Биология развития: В 3-х т. Т. 3: Пер. с англ. – М.: Мир, 1995. – 352с. 42 ГЛАВА 15
рикса необходимы обе субъединицы интегрина, то в трансмембранной связи с внутренним цитоскелетом решающее значение имеет цитоплазматическая область β-субъединицы. Клетки с мутантной субъединицей β1, лишенной именно этой области, не могут связываться с цитоскелетом, несмотря на то, что их внеклеточные домены могут связывать фибронектин (Solowska et al., 1989; Hayashi et al., 1990). Связывание цитоплазматического домена с талином и фибулином также показано биохимически (Horwitz et al., 1986; Argraves et al., 1989). Как видно из рис. 15.42, с каждой стороны молекулы интегрина находится ансамбль белков. С наружной стороны это сложный набор белков внеклеточного матрикса. С внутренней - это компоненты цитоскелета, особенно те, что связаны с движением клетки. Полагают, что связывание актиновых филаментов осуществляется посредством талина или α-актинина (Burridge, 1990). Продвижение клетки во время миграции с помощью актиновых микрофиламентов требует прикрепления их к субстрату. Это прикрепление обеспечивает интегрин. Однако в отличие от эпителиальных клеток, плотно прикрепляющихся к базальной мембране, прикрепление мигрирующих клеток к базальной пластинке при их миграции должно постоянно прерываться и возобновляться. Было показано (Beckerle et al., 1987), что в местах связывания интегрина с субстратом специфически локализуется кальций-зависимая протеаза, расщепляющая талин. Возможно, что эта протеаза разрушает мостики между рецептором фибронектина и цитоскелетом. При разрыве контакта между интегрином и фибронектином синтетическими пептидами из участков, где происходит адгезия, выделяются α-актинии и винкулин. Интегрины – не единственные молекулы, способные связываться с ламинином и фибронектином. Если рецептор интегрина связывается с RGD-последовательностью в А-цепи ламинина. то два других ламининовых белка связываются с различными последовательностями (Y1GSR) в В1-цепи (Graf et al., 1987; Yow et al., 1988). Как уже упоминалось, углеводные группы молекулы ламинина узнаются и другими белками. Эти рецепторы обладают различным сродством к ламинину, что имеет большое значение для их функционирования (Horwitz et al., 1985). Так, например, интегрин α3β1 фибробластов имеет относительно низкое сродство к ламинину (Кd = 10–6 М), тогда как сродство к ламинину рецептора ламинина эпителиальных клеток значительно выше (Кd = 2·10-9 М). Соответствующий рецептор может иметь существенное значение при использовании клеткой ламинина либо в составе базальной мембраны (при этом сродство рецептора должно быть высоким), либо в качестве субстрата для миграции (при этом используются рецепторы с низким сродством). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|