|
|
Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследованияИщи простоту и не верь ей. АЛЬФРЕД НОРТ УАЙТХЕД (1919) Для такого исследования необходимо изолировать инакопить в большом количестве не клеточные ядра и даже не отдельные хромосомы, а определенные части определенных хромосом из определенных клеток, только тогда химик сможет анализировать [наследственный материал] более углубленно, чем морфолог. ТЕОДОР БОВЕРИ (1904)
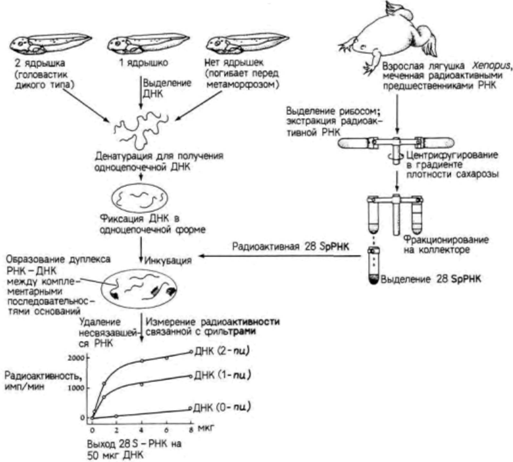
Введение Эмбриологи задавались вопросом, идентичны ли наборы генов в клетках разного типа одного и того же организма тому набору генов, который содержится в зиготе? Молекулярные биологи интересовались аналогичным вопросом: не является ли ДНК в клетках разного типа одинаковой, несмотря на различия в белках, синтезируемых этими клетками? Проблема осталась той же, но технические приемы, используемые для ее решения, усложнились. Вместо анализа отдельных органов или зародышей мы можем теперь рассмотреть индивидуальные последовательности ДНК и выяснить, присутствуют ли в клетках одни и те же гены и участвуют ли они в активном синтезе РНК. Прежде чем продолжить рассмотрение этой проблемы, нам следует познакомиться с методами молекулярной биологии. Методы молекулярной биологии Гибридизация нуклеиновых кислот Современные представления о генах эукариот и их РНК-продуктах были сформулированы главным образом на основе опытов по гибридизации нуклеиновых кислот. Методика гибридизации включает отжиг одноцепочечных фрагментов РНК и ДНК, позволяющий комплементарным цепям образовывать двухцепочечные гибриды. Например, если нуклеиновые кислоты разрезаны на небольшие фрагменты и каждый фрагмент диссоциирован на отдельные нити (т.е. денатурирован), то каждая нить по прошествии достаточного времени может найти комплементарного партнера и соединиться с ним. Условия ренатурации должны быть таковы, чтобы специфические гибриды комплементарных цепей сохранялись, а неспецифические гибриды диссоциировали. Обычно эти условия обеспечиваются изменением температуры или ионной силы раствора, в котором проходит ренатурация (Wetmur, Davidson, 1968). Сходным образом следует ожидать, что РНК, синтезируемая на каком-либо участке ДНК, будет связываться с цепью, на которой она синтезирована. Таким образом, предполагается, что РНК специфически гибридизуется с геном, который ее кодирует. Для определения уровня гибридизации одну из цепей нуклеиновой кислоты обычно метят радиоактивным изотопом. Возьмем для примера один эксперимент. Нерадиоактивную ДНК из печени лягушки можно денатурировать (ее цепи разделяются в щелочи) и иммобилизовать на нитроцеллюлозном фильтре. Радиоактивную РНК можно получить при введении радиоактивных предшественников РНК в другую лягушку или в культуру клеток лягушки.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. __________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ_______________ 81
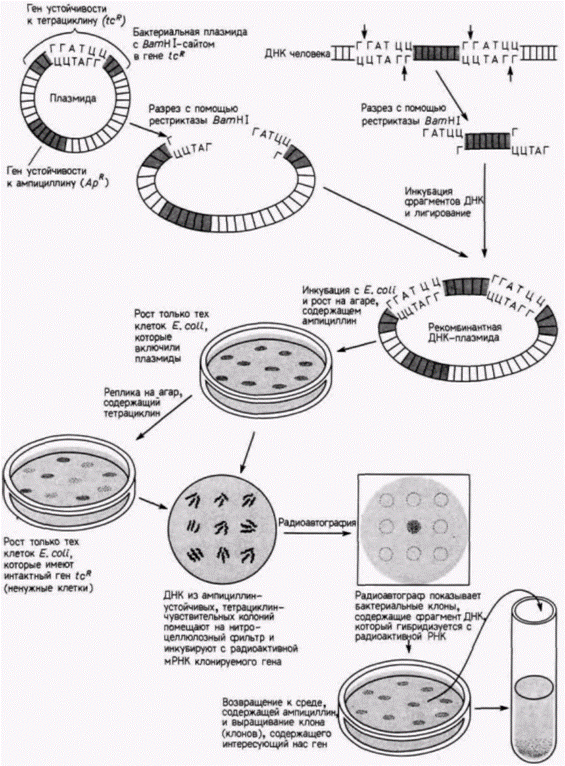
Затем выделяют рибосомы и экстрагируют из них радиоактивную рибосомную 28S-PHK (рРНК), которую добавляют к фильтрам с ДНК. Полагают, что радиоактивная РНК будет связываться только с теми участками ДНК. которые содержат гены для 28S-pPHK. Количество связавшейся РНК можно определить, измерив радиоактивность фильтров после удаления несвязавшейся РНК. Схема такого опыта и его результаты показаны на рис. 10.1. ДНК выделяли из нормальных головастиков с двумя ядрышками на клетку, а также из гомозиготных мутантов, полностью лишенных ядрышек, и гетерозиготных головастиков с одним ядрышком на клетку (Wallace, Birnstiel, 1966). ДНК, выделенную из каждой группы, денатурировали. По 50 мкг ДНК наносили на каждый из нескольких десятков бумажных фильтров: в одной группе фильтров – денатурированная ДНК из головастиков дикого типа; во второй – ДНК из мутантных головастиков; в третий – ДНК из гетерозиготных головастиков. Затем различные количества радиоактивной 28S-pPHK гибридизовали с тремя типами ДНК на фильтрах. На одни фильтры наносили небольшие количества радиоактивной ДНК, на другие – большие количества. Оказалось, что радиоактивная рРНК хорошо связывается с ДНК из нормальных головастиков, насыщая в конечном счете всю доступную ДНК. С ДНК из клеток головастиков, лишенных ядрышек, рРНК не связывалась, тогда как ДНК из гетерозиготных головастиков связывала лишь половину того количества рибосомной РНК, которое связывалось с ДНК из нормальных головастиков. Таким образом, было показано, что гены 28S-pPHK в геноме головастиков транскрибируются в области ядрышек. Одна из технических трудностей, связанных с гибридизацией нуклеиновых кислот, заключается в сложности получения молекул РНК с высокой радиоактивностью. Это затруднение можно преодолеть с помощью выделения РНК и получения комплементарной ДНК-копии (кДНК) в присутствии радиоактивных предшественников. Она может быть синтезирована в пробирке, содержащей РНК, короткий фрагмент ДНК, называемый праймером (затравкой), радиоактивные предшественники ДНК и вирусный фермент – обратную транскриптазу.Этот фермент способен синтезировать ДНК на РНК-матрице (рис. 10.2). Поскольку ДНК синтезируется in vitro, проблем с разведением радиоактивных предшественников не возникает. Кроме того, такая кДНК может гибридизоваться как с геном, синтезирующим РНК (хотя и с некодирующей цепью), так и с самой РНК. Это оказывается чрезвычайно полезным при регистрации небольших количеств специфических РНК. Клонирование генов Сравнительно недавно, используя методы гибридизации нуклеиновых кислот, биологам развития на основе подхода, названного клонированием генов, удалось выделить отдельные гены. Если бы кто-то захотел изолировать, например, отдельный ген человека, то он столкнулся бы с неразрешимыми проблемами. Геном человека содержит ДНК в количестве, достаточном для кодирования примерно 2 х 105 генов размером около 15 000 пар оснований каждый. Обычные биохимические процедуры не позволяют отделить один ген от всех остальных. Однако техника клонирования генов позволяет выделить специфические участки ДНК, а также провести их амплификацию до огромного числа копий. Первый этап в этой процедуре заключается в разрезании ядерной ДНК на различные фрагменты. Это осуществляется с помощью инкубации ДНК в присутствии рестрикционной эндонуклеазы (обычно называемой «рестриктазой»). Эти эндонуклеазы являются, как правило, бактериальными ферментами, которые узнают специфические последовательности ДНК (табл. 10.1) и расщепляют ДНК в этих участках (Nathans, Smith, 1975). Например, если ДНК человека инкубируют с ферментом BamH1(выделенным из Bacillus amyloliquifaciens, штамм H), то ДНК разрезается в каждом участке, где имеется последовательность ГГАТЦЦ. Продуктом реакции являются различные по длине фрагменты ДНК. содержащие Г на одном конце и ГАТЦЦ на другом (рис. 10.3). Следующий этап – включение полученных фрагментов ДНК в векторы для клонирования. Эти векторы представляют собой кольцевые молекулы ДНК, которые реплицируются в бактериальных клетках независимо от бактериальной хромосомы. Обычно используются плазмиды, устойчивые к тем или иным лекарственным препаратам, или специально модифицированные вирусы, которые особенно эффективны в случае клонирования больших фрагментов ДНК. Подобную плазмиду можно сконструировать таким образом, чтобы она содержала только один чувствительный к BamH1сайт. Ее можно раскрыть при инкубации с данной рестриктазой. После раскрытия она смешивается с фрагментированной ДНК. Во многих случаях нарезанные фрагменты ДНК оказываются включенными в векторы благодаря комплементарности их концов открытым концам вектора. Затем эти фрагменты могут соединяться ковалентно в растворе, содержащем фермент ДНК-лигазу. Итогом всей процедуры являются бактериальные плазмиды. каждая из которых содержит одиночный фрагмент ДНК человека. Их называют рекомбинантными плазмидами или просто рекомбинантной ДНК (Cohen et al.. 1973; Blattner et al.. 1978).
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. ________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ 83
1 Все сайты узнавания рестриктаз имеют центральную симметрию. Двухцепочечная последовательность, прочитанная в одном направлении, идентична последовательности, прочитанной в обратном направлении.
На рис. 10.3 показана плазмида pBR322, которая часто используется молекулярными биологами в качестве клонирующего вектора. Она несет два гена устойчивости к антибиотикам – tcR, который обеспечивает устойчивость к тетрациклину, и АрR, который делает бактерии устойчивыми к ампициллину. Эти гены устойчивости к антибиотикам, столь нежелательные для медиков, становятся незаменимыми для генных инженеров, поскольку один из BamH1 сайтов в этой плазмиде расположен в середине гена tcR. Предполагаемые рекомбинантные плазмиды. полученные описанным ранее способом, затем инкубируют с клетками Ε. coli дикого типа, чувствительными к обоим антибиотикам, в условиях, позволяющих бактериям захватить эти плазмиды. При этом не каждая бактерия включает плазмиду и не каждая плазмида включает чужеродный ген. т.к. липкие концы плазмиды в сайте рестрикции могут ренатурировать друг с другом. Для отбора тех бактерий, которые включили плазмиды, обработанные клетки Ε. coli выращивают на агаре в присутствии ампициллина. При этом выживают только те бактерии, которые включили плазмиды. Затем часть каждой жизнеспособной колонии переносится на агар, содержащий тетрациклин. Если бактерии продолжают рост, то, следовательно, ген tcRплазмиды остался интактным и эта плазмида восстановилась в результате простого соединения собственных концов друг с другом. Если бактерии, выросшие на среде с ампициллином, не выживают на среде с тетрациклином, то ген устойчивости к тетрациклину в плазмиде уже не функционирует. Это означает, что ген tcR разорван фрагментом фермента рестрикции из чужого генома. Со среды, содержащей ампициллин, отбираются те колонии, которые не росли на среде, содержащей тетрациклин. Эти колонии следует проверить на присутствие определенного гена. Клетки из каждой колонии E. coli, содержащей рекомбинантные плазмиды, помещают на нитроцеллюлозный фильтр. После лизиса клеток клеточная ДНК присоединяется к фильтру. Затем цепи ДНК разделяют с помощью нагревания и инкубируют фильтр в растворе, содержащем радиоактивную РНК (или ее кДНК-копию) для гена, выбранного для клонирования. Если плазмида содержит этот ген, то ДНК этого гена должна присутствовать на бумаге и только эта ДНК обладает способностью присоединять радиоактивную РНК или кДНК. Именно поэтому соответствующие места фильтра окажутся радиоактивными. Радиоактивность этих участков регистрируется с помощью радиоавтографии. Для этого чувствительная рентгеновская пленка помещается поверх обработанной бумаги. Электроны с высокой энергией, излучаемые радиоактивной РНК, сенсибилизируют зерна серебра в пленке, вызывая их потемнение при последующем проявлении. В результате над каждой колонией, содержащей рекомбинантную плазмиду с определенным геном, образуется темное пятно (рис. 10.3). Эти колонии изолируют и выращивают вновь. В итоге можно получить многие триллионы клеток, каждая из которых содержит сотни рекомбинантных плазмид. Рекомбинантные плазмиды можно отделить от хромосомы Ε. coli с помощью центрифугирования. Фрагмент ДНК человека, содержащий интересующий нас ген, высвобождается при инкубации плазмид с BamH1. Этот фрагмент затем отделяют от плазмидной ДНК. Таким образом, экспериментатор получает микрограммы очищенной ДНК, содержащей определенный ген. [Хотя описанная процедура выглядит вполне логичной и простой, число колоний, которые следует скринировать, достигает часто астрономических чисел. Число случайных фрагментов, которые должны быть клонированы, для того чтобы получить интересующий вас ген, возрастает с увеличением сложности генома организма1. Чтобы клонировать с 99%-ной надежностью желаемый ген из Е. coli, необходимо проанализировать примерно 1500 колоний. Для млекопитающих это число возрастет до 800 000: вместо
1 Сложность в данном случае определяется числом генов различного типа, содержащихся в клеточном ядре.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 84________________ ГЛАВА 10__________________________________________________________
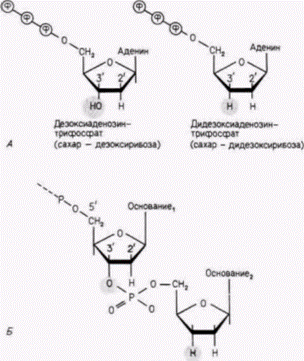
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ 85 того чтобы выращивать бактерии в стандартных чашках Петри, колонии зачастую выращивают на подносах из кафетериев (Blattner et al., 1978; Slightom et al., 1980).] При альтернативном методе клонирования в качестве исходного материала используется цитоплазматическая РНК, а не геномная ДНК. Как показано на рис. 10.2. можно получить цепи ДНК, комплементарные цепям мРНК. На следующем этапе процедуры одноцепочечную ДНК с помощью ДНК-полимеразы можно перевести в двухцепочечную. Полученные цепи ДНК после присоединения к ним подходящих «концов» могут быть встроены в плазмиды. Пришивка фрагментов ГАТЦЦ/Г к срезанным концам фрагмента ДНК создает искусственный рестрикционный BamH1-сайт и позволяет фрагменту ДНК самостоятельно встроиться в плазмиду, разрезанную ферментом. Такие коллекции клонов, полученных из мРНК. называют обычно библиотеками. Можно, например, получить библиотеку для печени мыши, которая будет содержать гены, участвующие в синтезе белков печени. Можно также получить библиотеку для вегетативного полушария ооцита Xenopus, которая будет представлять мРНК, содержащуюся только в этой части клетки. Полученные подобным образом гены представляют значительный интерес, поскольку они не содержат интронов. После добавления к бактериальным клеткам эти гены могут транскрибироваться и затем транслироваться в кодируемые ими белки. Дополнительные сведения и гипотезы: Когда ген клонирован... ... предстоит еще проделать большую работу. В последующих главах будет наглядно показано, что клонированные гены революционизировали наши представления о развитии. Некоторые методы использования рекомбинантных ДНК описаны ниже. Секвенирование Результаты секвенирования дают нам представление о структуре кодируемого белка и позволяют идентифицировать регуляторные последовательности ДНК, общие для ряда генов. (Например, в следующей главе мы увидим, что все гены, регулируемые гормоном прогестероном, содержат почти одинаковые последовательности ДНК вблизи начала участков, кодирующих белок.) Простота метода секвенирования с д2НТФ (Sanger et al., 1977) сделала этот метод обычным для многих молекулярно-биологических лабораторий. С использованием фага или плазмиды, несущих клонированный ген, выделяют одну цепь кольцевой ДНК (рис. 10.4). Затем гибридизуют радиоактивную ДНК-затравку (примерно из 20 нуклеотидов), которая комплементарна фаговой ДНК в области, непосредственно примыкающей к 5’-концу клонированного гена. (Так как эти последовательности известны, олигонуклеотидные затравки могут быть легко синтезированы или получены из коммерческих источников.) Затравка имеет свободный 3’-конец, к которому можно добавить дополнительные нуклеотиды. ДНК с затравкой и все четыре дезоксирибонуклеозидтрифосфата помешают в четыре пробирки. Каждая из пробирок содержит полимеризующую субъединицу ДНК-полимеразы и один из дидезоксирибонуклеозидтрифосфатов: одна пробирка содержит дидезокси-Г, другая - дидезокси-А и т. д. Структура дезокси- и дидезоксинуклеотидов представлена на рис. 10.5. Если дезоксинуклеотид лишен гидроксильной (ОН) группы при атоме углерода в 2-положении сахара, то дидезоксинуклеотид лишен гидроксильных групп при атомах углерода в двух положениях 2' и 3'. Поэтому, хотя дидезоксинуклеотид может присоединяться ДНК-полимеразой к растущей цепи ДНК, он останавливает дальнейший рост цепи, поскольку из-за отсутствия 3'-гидроксильной группы к нему не может присоединиться новый нуклеотид. Если ДНК-полимераза синтезирует ДНК от затравки, то новообразованная ДНК будет комплементарна клонированному гену. В пробирке с дидезокси-А каждый раз, когда ДНК-полимераза присоединяет А к растущей цепи, существует возможность, что вместо дезокси-А будет присоединен дидезокси-А. В том случае, когда это происходит, рост цепи останавливается. Аналогичным образом в пробирке с дидезокси-Г рост цепи с некоторой вероятностью останавливается каждый раз, когда присоединяется Г. (Все это напоминает греческий народный танец, где лишь небольшая группа из потенциальных танцоров одновременно участвуют в танце.) Поскольку в каждой пробирке синтезируются миллионы цепей, каждая пробирка будет содержать популяцию цепей, синтез которых остановлен в первом из возможных положений, в последнем и, наконец, в промежуточных положениях. Например, пробирка с дидезокси-А будет содержать
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ 87
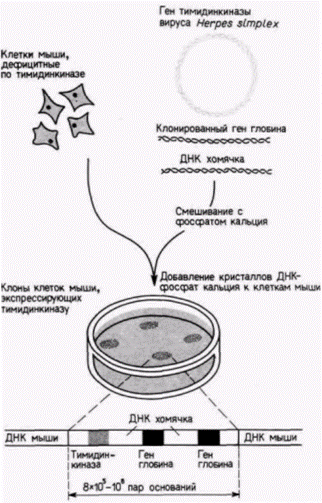
цепи различной дискретной длины, каждая из которых оканчивается остатком А. Полученные радиоактивные фрагменты ДНК разделяют с помощью электрофореза Смеси фрагментов вносят в лунки на одной стороне геля и затем пропускают через гель электрический ток. Отрицательно заряженные фрагменты ДНК мигрируют в направлении положительного полюса, при этом меньшие по размеру фрагменты движутся быстрее, чем крупные. Фрагменты с наименьшим числом нуклеотидов движутся быстрее, чем фрагменты с большим числом нуклеотидов (рис. 10.4 и 10.6). Прочитывая наборы полос, определяют последовательность ДНК, комплементарную клонированному гену. Перенос генов Во многих случаях желательно получить ген, модифицировать его и затем вернуть в эукариотический организм. Это осуществляется с помощью трансфекции - метода, посредством которого фрагменты ДНК можно ввести в хромосомную ДНК клетки. Клонированную ДНК смешивают с селективным маркерным геном (таким, как ген тимидинкиназы вируса Herpes simplex) и высокополимерной ДНК из какого-либо другого организма. Эту смесь инкубируют с фосфатом кальция: при этом образуются ДНК-содержащие кристаллы, которые фагоцитируются клетками в культуре. В случае дефицитных по тимидинкиназе клеток можно вырастить культуру в условиях, обеспечивающих выживание лишь тех клеток, которые захватили кристаллы ДНК–фосфат кальция (и потому экспрессируют ген тимидинкиназы) (Perucho et al., 1980; Robins et al., 1981). На рис. 10.7 показан опыт, в котором глобиновые гены человека смешивали с геном тимидинкиназы вируса Herpes и большими фрагментами ДНК хомячка. Селекция колоний на
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 88________________ ГЛАВА 10______________________________________________________________________________ присутствие тимидинкиназы выявила наличие в хромосоме мыши многочисленных глобиновых генов человека, чередующихся с ДНК хомячка (Watson et al., 1983). Недавно аналогичный метод был использован для переноса генов в стволовые клетки эмбриональной карциномы мыши. Эти стволовые клетки можно интегрировать в зародышей мыши, где из них впоследствии образуется часть тканей взрослой мыши (гл. 6). При последующем спаривании таких мышей новые гены могут попадать в каждую клетку их потомства (Gossler et al., 1986). Эффективность метода переноса с фосфатом кальция довольно низка, поэтому были разработаны другие методы. Один из них состоит в микроинъекции ДНК непосредственно в ядро (или пронуклеус) клетки (Capecchi, 1980; рис. 10.8). При хорошем навыке и специальном оборудовании можно инъецировать около 1000 клеток за час (в удачный день); при этом до 50% инъецированной ДНК интегрируется в хромосомы клеток. Этот метод был использован для введения генов ß-цепи глобина человека в зиготы мыши, дефицитные по ß-цепям. Развившиеся из этих зигот мыши имели функционирующие гены ß-цепи глобина человека, компенсировавшие генетическое заболевание (Constantini et al., 1986). Относительно новым методом является использование ретровирусных векторов. Ретровирусы это РНК-содержащие опухолеродные вирусы. Внутри клетки-хозяина они синтезируют свою ДНК-копию (используя собственную обратную транскриптазу): затем копия переводится в двухцепочечную форму и интегрируется в хромосому хозяина. Эта интеграция осуществляется благодаря присутствию двух идентичных последовательностей (длинных конце-
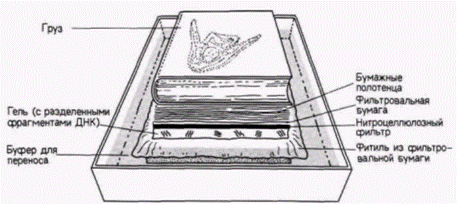
вых повторов) на концах ДНК. Ретровирусные векторы получены при помощи удаления генов, обеспечивающих упаковку вируса, из центральной части ретровируса мыши. Благодаря такому удалению создается свободный участок, куда можно поместить другие гены. Гены, которые были клонированы в плазмидах, могут быть выделены из них (с помощью подходящей рестриктазы) и встроены в ретровирусные векторы. Часть этого участка может быть занята селективным маркером (таким, как тимидинкиназа вируса Herpes simplex). Такие ретровирусные векторы инфицируют клетки мыши с эффективностью, достигающей 100%. Мышь со стабильными генами, полученными от других организмов (с помощью микроинъекции, вирусной инфекции или включения модифицированных стволовых клеток эмбриональной карциномы), называют трансгенной мышью. ДНК- и РНК-блоттинг ДНК-блоттинг (называемый также Саузерн-блоттингом или гибридизацией по Саузерну) представляет собой метод для выявления определенного гена (Sauthern, 1975) с последующим изучением его функций. С помощью ретровирусного вектора ген фактора, стимулирующего образование колоний гранулоцитов и макрофагов (КСФ-г,м). Вводили в клетки, которые в обычных условиях не синтезируют этот фактор, но чувствительны к нему ( Lang et al., 1985). Некоторые из клеток, обработанных рекомбинантным вирусом, начинали неконтролируемый рост, образуя после пересадки в мышь злокачественные опухоли. Получили ли все эти клетки дополнительные копии гена КСФ-г,м? Транскрибируют ли эти дополнительные гены мРНК для КСФ-г,м? На первый из этих вопросов ответ был получен с помощью ДНК-блоттинга. Ланг и его коллеги выделяли ДНК из клеток полученных злокачественных колоний и обрабатывали ее рестриктазой. Затем фрагменты ДНК разделяли с помощью электрофореза в геле. Помещая гель с фрагментами ДНК в раствор щелочи, добивались денатурации ДНК до отдельных цепей. После нейтрализации гель переносили на влажную фильтровальную бумагу на подложке из пластика (рис. 10.9). Нитроцеллюлозный фильтр (способный связывать одноцепочечную ДНК) помещали прямо на гель и накрывали его несколькими слоями бумажных полотенец. Края фильтровальной бумаги, лежащей под гелем, были опущены в сосуд с буфером высокой ионной силы. Буфер поднимался через гель и далее через нитроцеллюлозный фильтр и полотенца. При этом ДНК задерживалась на нитроцеллюлозном фильтре). После запекания ДНК на фильтре (иначе произойдет ее утечка) фрагменты
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ 89
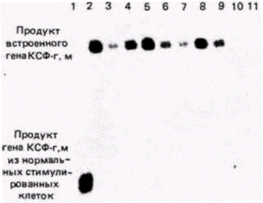
ДНК инкубировали с радиоактивной кДНК к соответствующему гену (можно использовать также и мРНК). Радиоавтограф нитроцеллюлозного фильтра показал, где радиоактивная ДНК нашла себе комплементарную ДНК. В итоге Лaнг с коллегами показали (рис. 10.10), что помимо двух обычных генов мыши, продуцирующих КСФ-г,м и расположенных в рестрикционном фрагменте длиной 7800 пар оснований, злокачественные клетки имеют ген КСФ-г,м, полученный от вируса (о чем свидетельствует наличие последовательностей вирусной ДНК) и лежащий в рестрикционном фрагменте длиной 5500 пар оснований. Для каждого из клонов злокачественных клеток был получен аналогичный результат. Экспрессию этих генов можно продемонстрировать с помощью РНК-блота (обычно называемого Нозерн-блотом). В отличие от Саузерн-блота, при котором из геля на бумагу переносят ДНК, при Нозерн-блоте (название не связано с фамилией исследователя) аналогичным образом из геля на бумагу переносят РНК. Нозерн-блоты весьма полезны при изучении накопления специфических мРНК в цитоплазме определенной клетки. В данном случае цитоплазматическую РНК изолируют из злокачественных клеток, инфицированных ретровирусом, содержащим ген КСФ-г,м, и из незлокачественных клеток, инфицированных аналогичным ретровирусом, но лишенным гена КСФ-г,м. РНК из каждого клеточного клона фракционировали в геле и переносили на нитроцеллюлозный фильтр. После инкубации фильтра с кДНК к гену КСФ-г,м было обнаружено, что во всех злокачественных клонах транскрибируется ген КСФ-г,м. Другие клетки его не транскрибируют (рис. 10.11). Ланг с соавторами пришли к выводу, что в клетках транскрибируется искусственно выделенный ген КСФ-г,м, находящийся под контролем вируса. Далее оказалось, что эти клетки, которым требуется КСФ-г,м для роста, приобрели способность синтезировать свой собст-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 90 ГЛАВА 10
венный КСФ-г,м. Таким образом, они стимулируют себя к непрерывному делению, образуя в конечном счете опухоли. [Это наблюдение подтверждало гипотезу Тодаро и др. (Todaro et al., 1977), которые предсказали подобный феномен в 1977 г. Эти опыты по индукции опухолей будут подробно рассматриваться в гл. 20.] Одним из важных применений Нозерн-блота является определение времени начала экспрессии какого-либо конкретного гена. Исследователь может выделить препараты РНК из зародышей на различных стадиях развития и разделить их с помощью электрофореза на параллельных дорожках геля. После переноса расфракционированной РНК на нитроцеллюлозный фильтр методом блоттинга фильтр со связанной РНК инкубируют в растворе, содержащем радиоактивный одноцепочечный фрагмент ДНК исследуемого гена. Эта ДНК будет связываться только с теми участками, где находится комплементарная РНК. Таким образом, если мРНК для данного гена присутствует на определенной стадии эмбриогенеза, то радиоактивная ДНК должна связываться с ней и ее можно зарегистрировать с помощью радиоавтографии. Радиоавтографы этого типа называют Нозерн-блотами развития. На рис. 10.12 показан Нозерн-блот развития для экспрессии гена алкогольдегидрогеназы у Drosophila. Можно видеть, что мРНК для этого белка синтезируется на всех стадиях зародышевого развития, кроме стадии куколки, и у взрослой особи (Savakis, Ashburner, 1985). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|





 •
•