|
|
Дополнительные сведения и гипотезы: Внутриклеточная локализация и движения морфогенетических детерминантовРазличные компоненты оплодотворенного яйца (в том числе желток, пигмент и растворимые белки) можно легко сместить центрифугированием, однако такое смешение обычно не влияет на эмбриогенез (см. обзор Morgan. 1927). Из этого следует, что либо молекулы детерминантов слишком малы, чтобы двигаться под действием центрифугирования, либо они каким-то образом закреплены в яйце («заякорены»). Отсутствие диффузии, о которой свидетельствует цитоплазматическая локализация этих детер-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. __________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ________________ 15 минантов, опровергает первую возможность. Более вероятно, что детерминанты прикреплены к нерастворимому материалу, возможно к цитоскелету клетки. Эта инфраструктура, состоящая из филаментов и трубочек, распространена по всей клетке, но особенно хорошо выражена в кортикальном слое цитоплазмы ооцита. Было показано (Cervera el al., 1981). что в культивируемых клетках большая часть РНК ассоциирована с цитоскелетом. Следовательно, цитоскелет может являться местом специфической локализации цитоплазматических детерминантов. Цитоскелет можно выделим, из клеток с помощью неионных детергентов, таких, как тритон Х-100. Детергент растворяет липиды, тРНК и монорибосомы. Остающийся цитоскелет содержит микротрубочки, микрофиламенты. промежуточные филаменты и примерно 200 белков, в том числе белок, способный связываться с 5’-концом мРНК (Zumbe et al.. 1982: Moon et al.. 1983). У оболочников Styela и Boltenia желтый серп, из материала которого формируются мышцы, характеризуется актинсодержащим цитоскелетным доменом. Этот домен первоначально распределен в неоплодотворенном яйце равномерно. После оплодотворения, однако, актиновые микрофиламенты сокращаются и сегрегируются в бластомерах. предназначенных для формирования мышц, при этом они захватывают с собой желтые пигментные гранулы и ряд мРНК (Jeffery, Meier. 1983; Jeffery. 1984). На рис. 7.8 можно видеть, что цитоскелет содержит желтые пигментные гранулы, которые получили свою внутриклеточную локализацию в результате движений цитоплазмы ооцита в период оплодотворения. Белки этой области желтого серпа значительно отличаются от белков остальной части яйца, тогда как мРНК этой области, по-видимому, не являются специфичными для желтою серпа (Jeffery. 1985). Таким образом, цитоскелет может служить якорем для морфогенетических факторов, детерминирующих судьбу клетки зародыша. Локализация специфических белков или мРНК в специфических областях яйца не ограничена «мозаичными» зародышами. Было показано (Weeks et al.. 1985). что анимальные и вегетативные шапочки яиц амфибий также содержат некоторые уникальные мРНК Эти исследования начались с выделения мРНК из растущих ооцитов (рис. 7.9). Используя методику, которая будет подробно изложена в гл. 10. исследователи выделили и очистили мРНК из различных областей яйца лягушки. Большая часть мРНК из анимальной и вегетативной шапочек яйца оказались идентичными, однако небольшой процент РНК из анимальной области не был представлен в вегетативной цитоплазме, а некоторые мРНК вегетативной шапочки не были обнаружены в анимальной цитоплазме. Одна из таких уникаль-
ных вегетативных мРНК была обнаружена в опытах, в которых развивающиеся яйца лягушки инкубировали с радиоактивной ДНК. комплементарной этой мРНК из вегетативной области. (Эта кДНК была получена путем транскрибирования РНК на другой нити ДНК этого гена). Если комплементарная ДНК находила эту мРНК. то она связывалась С ней и оставалась в клетке. Присутствие радиоактивности выявляли с помощью фотографической эмульсии, на которой после экспозиции и проявления оставался след. Рис. 7.9 показывает, что в ранних ооцитах эта мРНК из вегетативной области (называемая Вг1) обнаруживается во всем ооците. Правда, по мере развития ооцита она становится локализованной в вегетативной области яйца (Melton. 1987). Механизм перемещения Brl в вегетативную область пока неизвестен.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 16________________ ГЛАВА 7______________________________________________________________________________
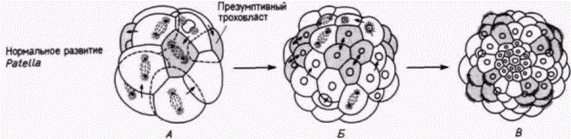
В начале века выдающийся американский эмбриолог Вильсон опубликовал результаты интереснейших опытов. Он изолировал ранние бластомеры зародышей моллюска Patella coerulea и сравнивал их развитие с развитием таких же клеток, оставленных в других зародышах. На рис. 7.10 приведены некоторые результаты опытов, опубликованные Вильсоном в 1904 г. Изолированные бластомеры не только дифференцировались соответственно их проспективному значению (в этом случае формировались реснитчатые клетки трохобласта). но и осуществляли то же самое число клеточных делений и точно в то же самое время, как это делали такие же клетки, оставшиеся в интактном контрольном зародыше. Ориентация этих делений дробления была правильной, и в соответствующее время образовавшиеся клетки формировали реснички. На основании результатов своих опытов Вильсон пришел к выводу, что сами клетки содержат факторы, детерминирующие форму и ритм делений дробления, а сложная дифференцировка. которую они претерпевают, не зависит полностью от их связей с остальной частью зародыша.
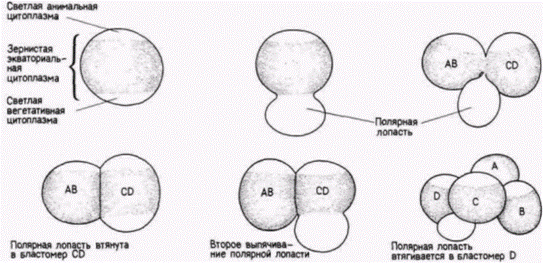
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. __________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ____________ 17 Полярная лопасть В своем следующем опыте Вильсон сумел покатать, что такое развитие предопределено сегрегацией (распределением) специфических морфогенетических детерминантов по специфическим бластомерам. У зародышей некоторых животных со спиральным дроблением (главным образом у моллюсков и кольчатых червей) непосредственно перед первым делением дробления образуется вырост цитоплазмы (рис. 7.11). Этот вырост называют полярной лопастью. У некоторых видов улиток участок, соединяющий полярную лопасть с яйцом, представляет собой тонкую перемычку. Первое деление дробления делит зиготу асимметрично таким образом, что полярная лопасть соединяется только с бластомером CD. У некоторых видов почти одна треть всего объема цитоплазмы сосредоточена в этой безъядерной лопасти, что придает ей вид отдельной клетки. Стадию двух бластомеров. на которой зародыш имеет такую трехдольную структуру, часто называют трилистником (рис. 7.12). Затем полярная лопасть втягивается в бластомер CD, но снова образуется перед вторым делением (рис. 7 11). После этого деления полярная лопасть оказывается прикрепленной только к бластомеру D, в который она и втягивается. В дальнейшем полярная лопасть более не образуется. Вильсон показал, что если удалить полярную лопасть на стадии трилистника, оставшиеся клетки делятся нормально. Однако вместо образования нормальной трохофоры (личинки улитки) развивается неполная личинка, совершенно лишенная мезодермальных органов мышц, рта, раковинной железы1 и ноги. Кроме того, Вильсон обнаружил, что тот же самый тип аномального зародыша может быть получен в результате удаления бластомера D на 4-клеточной стадии. На основе этого он пришел к выводу, что цитоплазма полярной лопасти содержит детерминанты мезодермы, которые и придают бластомеру D его способность формировать мезодерму. Вильсон также показал, что локализация мезодермальных детерминантов устанавливается вскоре после оплодотворения и что специфическая цитоплазматическая область яйца, предназначенная быть включенной в бластомер D, содержит какие-то «факторы», необходимые для установления особого ритма дробления бластомера D и для дифференцировки мезодермы. Морфогенетические детерминанты, содержащиеся в полярной лопасти, по-видимому, локализованы в цитоскелете или в кортикальном слое, а не в жидкой части цитоплазмы зародыша. Клемент (Clement, 1968) центрифугировал зародышей улитки Ilyanassa obsoleta на стадии трилистника, вызывая перетекание жидкой части цитоплазмы обратно в бластомер CD. Однако, когда он затем отрезал полярную лопасть, у сформировавшегося зародыша опять отсутствовали производные мезодермы. Ван ден Биггелаар получил сходные результаты, удаляя цитоплазму из полярной лопасти микропипеткой. Жидкая цитоплазма из других областей клетки
1 Раковинная железа эктодермальный орган, формирующийся благодаря индукционному влиянию мезодермальных клеток. Без мезодермы в зародыше нет клеток, способных индуцировать компетентную эктодерму. Таким образом, мы снова встречаемся с ограниченной индукцией у мозаичного зародыша.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 18 ГЛАВА 7
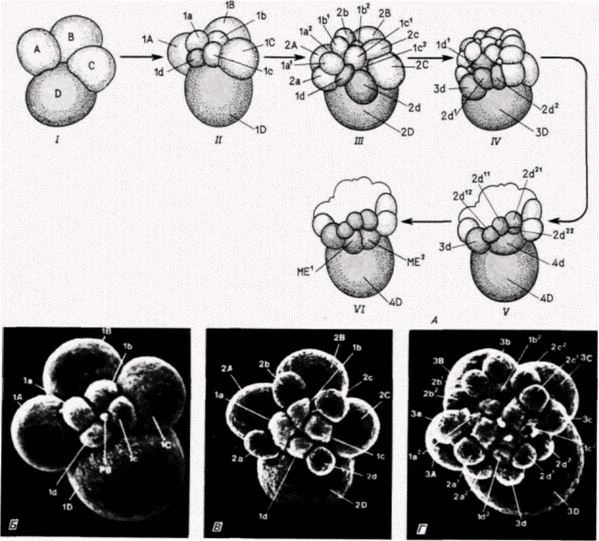
перетекала в полярную лопасть и замещала удаленную порцию; при этом последующее развитие зародышей было нормальным. В дополнение к этому, когда он добавлял жидкую цитоплазму полярной лопасти в бластомер В. удвоения структур не наблюдалось (Verdonk, Gather, 1983). Следовательно, жидкая часть цитоплазмы не содержит этих морфогенетических детерминантов. Они, вероятно, находятся в нерастворимой кортикальной цитоплазме или в цитоскелете. Клемент изучал также развитие бластомера D с целью проследить дальнейшее распределение этих детерминантов. Развитие бластомера D представлено на рис. 7.13. Этот макромер. получивший содержимое полярной лопасти, крупнее трех других. После удаления бластомера D или его первого или второго производных (ID или 2D) из оставшихся бластомеров развивается неполная личинка, у которой отсутствуют сердце, кишечник, парус (снабженный ресничками край личинки), раковинная железа, глаза и нога. Если удалить бластомер 3D после деления бластомера 2D. приводящего к образованию бластомера 3D. то получаются почти нормальные зародыши, имеющие глаза, ногу, парус, а некоторые и раковинную железу, но лишенные сердца или кишечника (рис. 7.14). Следовательно, некоторые из морфогенетических детерминант, первоначально находившиеся в бластомере D, перешли в клетку 3d. После того как образовалась клетка 4d (после деления бластомера 3D), удаление производного бластомера D (клетки 4D) не вызывает качественных изменений в развитии. Все детерминанты, важные для формирования сердца и кишечника, теперь содержатся в бластомере 4d, и удаление именно этой клетки приводит к образованию личинки без сердца и кишки (Clement. 1986). Бластомер 4d ответствен за формирование (при его последующем делении) двух мезэнтобластов клеток, из потомства которых образуются как мезодермальные (сердце), так и энтодермальные (кишечник) органы. Материал полярной лопасти также ответствен за организацию дорсовентральной (спина-живот) полярности зародыша. Если позволить материалу полярной лопасти перейти в оба бластомера (AB и CD), то образуются личинки-близнецы, соединенные между собой на вентральной поверхности (Guerrier et al., 1978; Henry, Martindale, 1987). Таким образом, опыты показали, что нерастворимая цитоплазма полярной лопасти чрезвычайно важна для нормального развития моллюсков, потому что она: 1) содержит детерминанты для соответствующего ритма и ориентации делений дробления бластомера D; 2) содержит определенные детерминанты (поступающие в бластомер 4d и приводящие затем к образованию мезэнтобластов). необходимые для дифференцировки мезодермы и кишечника; 3) ответственна за запуск индукционных взаимодействий (через материал, поступающий в бластомер 3d), приводящих к формированию раковинной железы и глаза; 4) содержит детерминанты, необходимые для спецификации дорсовентральной оси зародыша. Хотя очевидно, что полярная лопасть важна для
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ 19
нормального развития улитки, мы все еще не знаем механизма ее действия. По-видимому, существенных различий в синтезе мРНК или белков у зародышей с полярной лопастью и без нее не наблюдается (Brandhorst, Newrock, I981; Collier, 1983, 1984). Возможный ключ к пониманию этого механизма дали наблюдения (Atkinson. 1987), показавшие наличие дифференцированных клеток паруса, пищеварительной системы и раковинной железы у зародыша без полярной лопасти. У такого зародыша могут образовываться эти клетки, но они оказываются неспособными организоваться в функциональные ткани и органы. Можно обнаружить в зародыше ткани пищеварительного тракта, но они не соединены между собой в целую систему, а миоциты рассеяны по личинке и также не организованы в функциональную мышечную ткань. Таким образом, функции полярной лопасти в развитии могут быть очень сложными.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 20________________ ГЛАВА 7_______________________________________________________________________________
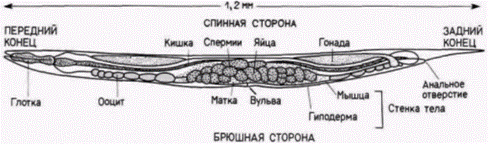
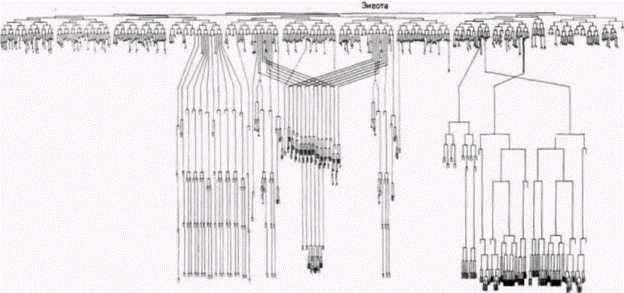
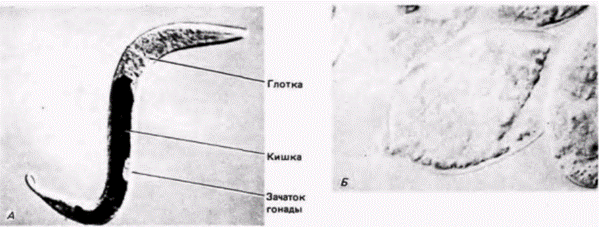
Детерминация у нематоды Caenorhabditis elegans Для анализа закономерностей развития необходимы подходящие объекты изучения. Долгое время одним из излюбленных объектов эмбриологических исследований служили морские ежи, потому что их гаметы легко получать в больших количествах, их яйца и зародыши прозрачны, а оплодотворение и развитие могут происходить в лабораторных условиях. Но в условиях лаборатории трудно вырастить больше одного поколения морских ежей, а это делает практически невозможными генетические исследования. Генетики же (по меньшей мере те из них, кто работает с многоклеточными эукариотами) предпочитают дрозофилу. Короткий жизненный цикл, легкость разведения и наличие политенных хромосом у личинки мухи (позволяющих изучать локализацию генов) делают это животное в высшей степени подходящим для генетического анализа. Однако эмбриогенез дрозофилы очень сложен и его трудно изучать. Исследовательской группе. возглавляемой Сиднеем Бреннером (Brenner, 1974), удалось найти организм, у которого можно идентифицировать каждый ген, участвующий в развитии, и в то же время проследить судьбу клеток, происходящих от каждой единичной клетки. Это мелкая (1 мм), свободно живущая почвенная нематода Caenorhabditis elegans (рис. 7.15). Продолжительность эмбриогенеза у нее невелика (около 16 ч). все развитие может завершиться в чашке Петри, число образующихся типов клеток также невелико. Этот червь является гермафродитом – каждая особь содержит и яйца, и спермии. Размножение происходит путем либо перекрестного оплодотворения, либо самооплодотворения. Тело гермафродитного С. elegans содержит точно 959 соматических клеток, происхождение которых может быть полностью картировано с помощью наблюдений через прозрачную кутикулу (рис. 7.16: Sulston. Horvitz. 1977; Kimble, Hirsh. 1979). Кроме того, в отличие от позвоночных клеточные линии С. elegans почти не меняются от
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ 21
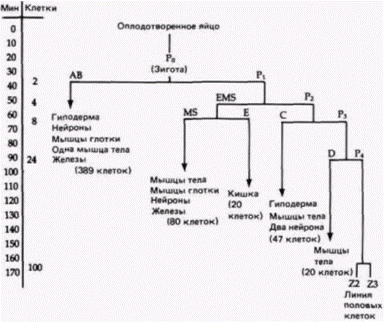
одной особи к другой. В их развитии мало места для случайности (Sulston et al.. 1983). (Это является следствием пространственной упорядоченности цитоплазматической сегрегации.) С. elegans также имеет небольшое для многоклеточного организма число генов около 3000, что примерно в 35 раз меньше, чем у млекопитающих. Локализация цитоплазматических веществ у этого вида была продемонстрирована в убедительных и изящных опытах. Одним из таких веществ являются гранулы первичных половых клеток и их потомков (Р-гранулы), которые вскоре после оплодотворения перераспределяются в зиготе и локализуются исключительно в тех клетках, которые спо-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 22________________ ГЛАВА 7_______________________________________________________________________________
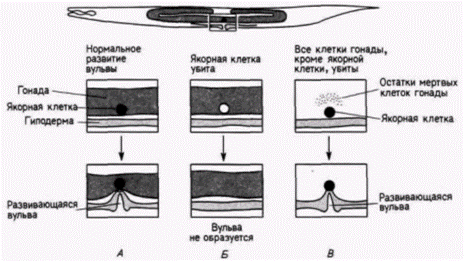
собны к формированию гамет (рис. 7.17). Используя связанные флуоресцирующие антитела к компонентам Р-гранул. Штром и Вуд (Strome. Wood. 1983) показали, что во время миграции пронуклеусов случайно рассеянные в цитоплазме Р-гранулы локализуются в заднем отделе зиготы (двигаясь к месту проникновения спермия) и попадают только в бластомер Р1, формирующийся из цитоплазмы, находящейся в этом отделе (рис. 7.18 и цветная таблица на внутренней стороне обложки книги). При последующем делении дробления Р-гранулы до начала митоза рассеиваются по всей цитоплазме бластомера P1, но во время митоза снова мигрируют к заднему концу клетки. Здесь они оказываются сосредоточенными в бластомере Р2. В конце концов Р-гранулы локализуются в бластомере Р4, потомки которого станут яйцами и спермиями взрослого животного. Для движения Р-гранул необходимы микрофиламенты, но оно может происходить вотсутствие микротрубочек. Обработка зиготы цитохалазином D (ингибитором образования микрофиламентов) предотвращала сегрегацию этих гранул на заднем конце клетки, тогда как демеколцин (сходный с колхицином ингибитор образования микротрубочек) не останавливал их движения (Strome. Wood. 1983). Достигнув заднего участка зиготы, Р-гранулы остаются там, даже если микрофиламенты после этого разрушаются (Hill, Strome. 1987). Механизмы движения Р-гранул и их прикрепления к микрофиламентам до сих пор неизвестны. Характер развития большинства клеток С. elegans является типично мозаичным: их судьба строго детерминирована внутренними цитоплазматическими факторами, а не взаимодействиями между соседними клетками Так, детерминанты для линии клеток, из которых образуется кишка, во время первого деления дробления локализованы в клетке P1, из которой позже образуется клетка предшественник кишки (клетка Е) (рис. 7.19: Laufer et al.. 1980; Edgar. McGhee. 1986). Однако, как и у оболочников, у нематод сохраняется некоторая возможность клеточных взаимодействий. Кимбл (Kimble. 1981) использовал пучок лазерных лучей, чтобы избирательно убить специфические клетки, потомки которых формируют вульву (проход, через который происходит откладка яиц). Одна из клеток в этой области становится якорной клеткой, соединяющей лежащую над ней гонаду с вульвой. Если эту клетку разрушить, то гиподермальные (кожные) клетки не делятся и не образуют вульву. Однако, пока якорная клетка находится вблизи гиподермы, вульва формируется. Это свидетельствует о том. что якорная клетка индуцирует образование вульвы (рис. 7 20). Кроме того, шесть клеток-предшественников вульвы под влиянием якорной клетки формируют эквивалентную группу В процессе нормального развития три центральные клетки этой группы делятся, образуя вульву, тогда как из трех других клеток образуются шесть гиподермальных клеток. (Если якорная клетка разрушена, то все шесть клеток эквивалентной группы делятся один раз. в результате чего возникают 12 гиподермальных клеток.) Если разрушить три центральные клетки, то три другие клетки, которые в норме образуют гиподерму, дадут начало клеткам вульвы. Таким образом, как мы уже видели на примере оболочников и улиток, явления регуляции и индукции до некоторой степени встречаются и у организмов, эмбриональное развитие которых жестко детерминировано.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. __________________ ДЕТЕРМИНАЦИЯ ПОСРЕДСТВОМ ЦИТОПЛАЗМАТИЧЕСКОЙ СПЕЦИФИКАЦИИ________________ 23
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 24________________ ГЛАВА 7_______________________________________________________________________________ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
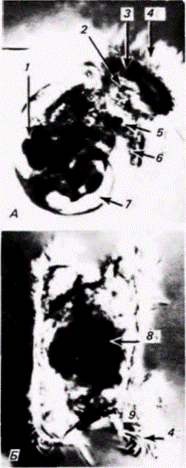
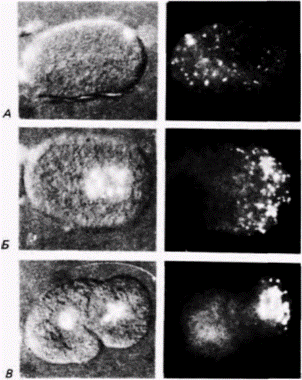
 Рис. 7.8. Сегрегация морфогенетических детерминантов в яйцах оболочников. Яйца обрабатывали тритоном Х-100 детергентом, растворяющим мембрану, что позволяло наблюдать цитоскелетные компоненты. А. Неоплодотворенное яйцо Styela; желтые пигментные гранулы и цитоскелет видны по всей поверхности, А Сегрегация желтой цитоплазмы в только что оплодотворенной зиготе Boltenia. Область, содержащая желтые пигментные гранулы, приподнята и состоит из собственно плазматической мембраны и лежащего глубже сплетения филаментов. Предполагаемое направление миграции пигмента показано стрелкой. Фотографии получены с помощью сканирующего электронного микроскопа. (Из Jeffery. Meier. 1983: фотографии с любезного разрешения S. Meier.)
Рис. 7.8. Сегрегация морфогенетических детерминантов в яйцах оболочников. Яйца обрабатывали тритоном Х-100 детергентом, растворяющим мембрану, что позволяло наблюдать цитоскелетные компоненты. А. Неоплодотворенное яйцо Styela; желтые пигментные гранулы и цитоскелет видны по всей поверхности, А Сегрегация желтой цитоплазмы в только что оплодотворенной зиготе Boltenia. Область, содержащая желтые пигментные гранулы, приподнята и состоит из собственно плазматической мембраны и лежащего глубже сплетения филаментов. Предполагаемое направление миграции пигмента показано стрелкой. Фотографии получены с помощью сканирующего электронного микроскопа. (Из Jeffery. Meier. 1983: фотографии с любезного разрешения S. Meier.)