|
|
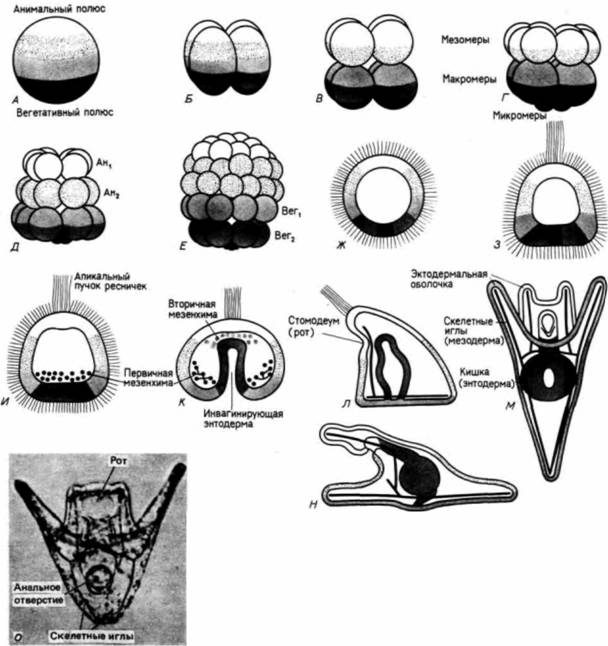
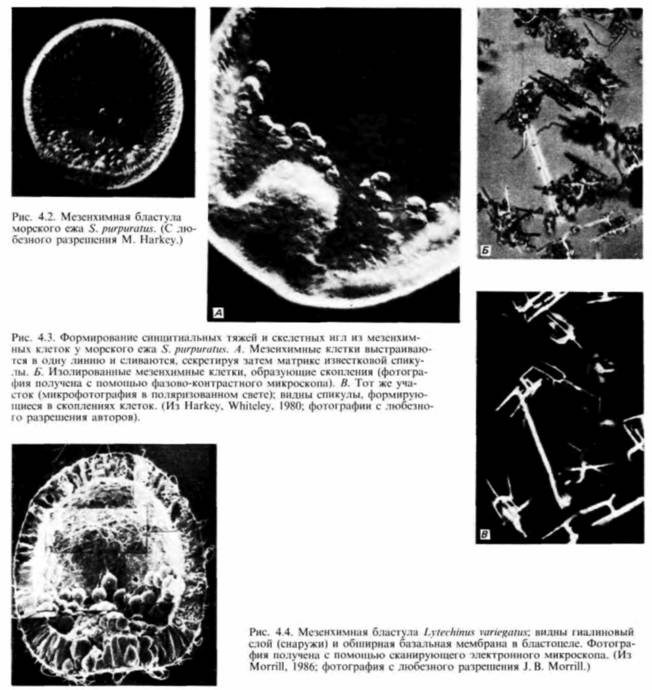
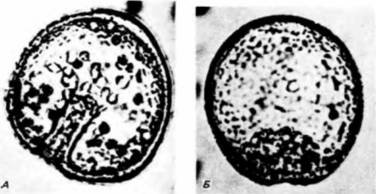
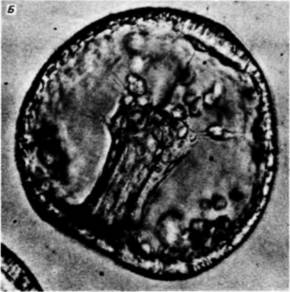
Выселение первичной мезенхимыПримерно через 24 ч после вылупления бластулы из оболочки оплодотворения вегетативный участок стенки сферической бластулы начинает уплощаться. В центре этой плоской вегетативной пластинки находится скопление мелких клеток, на поверхности которых, обращенной в бластоцель, появляются длинные тонкие (30 х 5 мкм) выросты, называемые филоподиями Растягиваясь и сокращаясь, филоподии совершают пульсирующие движения. Затем клетки отделяются друг от друга и мигрируют в бластоцель. Они называются первичной мезенхимой и происходят из микромеров (рис. 4.2). Густафсон и Волперт (Gustafson. Wolpert, 1961) с помощью цейтраферной киносъемки проследили под микроскопом движения этих клеток в бластоцеле. Сначала движения мезенхимных клеток вдоль События, происходящие в цитоплазме и на поверхности клеток, являются ключевыми для выселения и миграции первичных мезенхимных клеток. Густафсон и Волперт (Gustafson. Wolpert. 1967) предложили модель, согласно которой иммиграция микромеров происходит благодаря изменениям их адгезивных 1 Обсуждение гаструляции у дрозофилы отложено до гл. 18, в которой она рассматривается в связи с формированием характерных черт развития у этих насекомых.
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с.
112 ГЛАВА 4
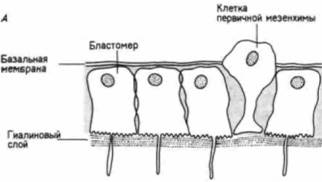
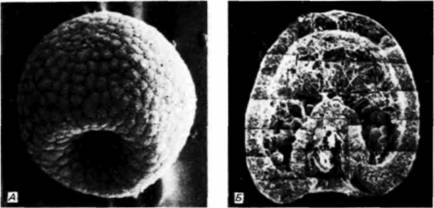
свойств по отношению к другим клеткам и окружающему их внеклеточному матриксу. Первоначально все клетки бластулы соединены по своей наружной поверхности с гиалиновым слоем (возникающим при оплодотворении из кортикальных гранул), а по внутренней — с базальной мембраной (внеклеточным матриксом, секретируемым клетками). Внеклеточный матрикс нельзя увидеть в световом микроскопе, но его можно обнаружить с помощью сканирующего электронного микроскопа (рис. 4.4). С боковых сторон каждая клетка имеет в качестве соседа другую клетку. Финк и Мак-Клей (Fink, McClay, 1985) подтвердили предположение Густафсона и Волперта. измерив силу адгезии бластомеров морского ежа с гиалиновым слоем, базальной мембраной и с другими клетками. Они обнаружили, что потомки макромеров и мезомеров очень прочно связаны друг с другом и с гиалиновым слоем, но
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. ГАСТРУЛЯЦИЯ ПЕРЕРАСПРЕДЕЛЕНИЕ КЛЕТОК 113
очень рыхло - с базальной мембраной (табл. 4.1). Характер связывания микромеров на стадии бластулы вначале был сходным. Однако в ходе гаструляции адгезивные свойства микромеров менялись. И если другие клетки сохраняли плотную связь с гиалиновым слоем и с соседними клетками, то микромеры гаструлы теряли свое сродство к этим структурам (оно уменьшалось до 2% первоначального значения), а сродство к базальной мембране увеличивалось в 100 раз. Эти изменения свойств микромеров приводят к тому, что они открепляются от наружного гиалинового слоя и от своих соседей и, притягиваемые базальной мембраной, мигрируют в бластоцель (рис. 4.5). Изменения в сродстве коррелировали
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 114 ГЛАВА 4
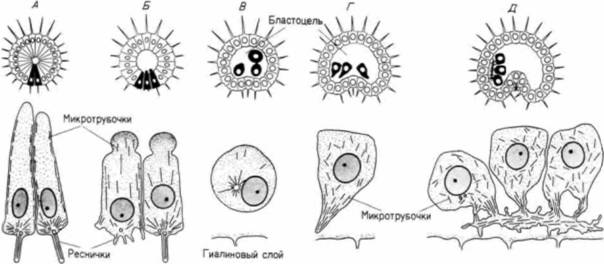
с происходившими в это время изменениями в составе молекул клеточной поверхности. Антиген клеточной поверхности, Мезо 1, обнаруживался точно тогда, когда наблюдалась миграция мезенхимных клеток из стенки бластулы (рисунок на внутренней стороне обложки). Как видно из рис. 4.4. вокруг вселяющихся в бластоцель клеток первичной мезенхимы концентрируется внеклеточный матрикс (Galileo. Morrill. 1985). Кроме того, попав внутрь бластоцеля, первичные мезенхимные клетки с помощью филоподий мигрируют по внеклеточному матриксу (рис. 4.6: Galileo. Morrill, 1985; Karp, Solursh, 1985). По-видимому, для их миграции важны два белка. Один из них — фибронектин, высокомолекулярный (400 000 дальтон) гликопротеин, который является обычным компонентом базальных мембран, в том числе и базальной мембраны у морского ежа (Wessel et al.. 1984). Финк и Мак-Клей (Kink. McCIay. 1985) показали, что во время гаструляции сродство микромеров к этому белку резко возрастает, а Като и Хайяши (Katoh. Hayashi. 1985) обнаружили, что миграция мезенхимных клеток зависит от концентрации фибронектина. Второй набор молекул — это сульфатированные гликопротеины, обнаруженные на клеточной поверхности выселяющихся в бластоцель мезенхимных клеток (Sugiyama. 1972; Heifctz, Lcnnarz, 1979). Если синтез (или сульфатирование) этих гликопротеинов подавлен, то мезенхимные клетки будут выселяться в бластоцель, но не станут двигаться в нем ( Karp. Solursh. 1974; Anstrom et al.. 1987; рис. 4.7). Гиббинс и др. (Gibbins et al.. 1969) показали, что для формирования и миграции мезенхимных клеток чрезвычайно важное значение имеет ориентация микротрубочек. В клетках ранней бластулы микротрубочки распределены асимметрично вдоль длинной оси клетки (рис. 4.8). По мере того как клетки первичной мезенхимы приобретают амебоидную форму и теряют контакт с бластодермой, микротрубочки
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. ___________ ГАСТРУЛЯЦИЯ: ПЕРЕРАСПРЕДЕЛЕНИЕ КЛЕТОК 115
утрачивают свою ориентацию и их расположение становится случайным. Микротрубочки перемешаются в область филоподий мигрирующих клеток и позже обнаруживаются в синцитиальных тяжах. Если эти микротрубочки разрушить (например, колхицином), то мезенхимные клетки теряют свои филоподиальные отростки и миграция прекращается (Tilney, Gibbins. 1969). Первая фаза инвагинации Пока в вегетативной области бластоцеля формируется кольцо клеток первичной мезенхимы, в клетках, которые остаются в вегетативной пластинке, происходят важные изменения. Эти клетки связаны между собой и с гиалиновым слоем яйца и движутся, чтобы заполнить пространства, образованные в ре-
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 116 ГЛАВА 4
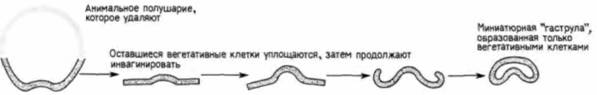
зультате иммиграции мезенхимы: поэтому пластинка продолжаем уплощаться. Далее она изгибается и впячивается в бластоцель примерно на 1/4-1/2 своего пути (рис. 4.9). Затем инвагинация внезапно прекращается. Инвагинировавшая область называется архентероном или гастроцелем, а отверстие архентерона в вегетативной области называется бластопором Эта первая фаза инвагинации вегетативной пластинки, по-видимому, обусловлена силами, заключенными в самой вегетативной пластике, и никак не связана с давлением клеток, лежащих над нею. Мур и Барт (Moore. Burl. 1934) разрезали зародышей иглокожих на анимальную и вегетативную половины. Вегетативная половина начинала инвагинировать даже в отсутствие анимальной половины. Инвагинация при этом достигала 1/4-1/3 расстояния до анимального полюса, т.е. была примерно такой же величины, как и на первой фазе инвагинации при нормальном развитии (рис. 4.10). По мере того как впячивание углублялось, края разреза вегетативной половины вворачивались внутрь и сливались, так что в результате формировалась миниатюрная «гаструла». Предположение Мура (Moore. l941), что эта фаза инвагинации обусловлена различиями в когезивности клеток, получило поддержку в исследованиях Густафсона и Boлперта (Gustafson, Wolperl, 1961 ), про-
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. _______ ГАСТРУЛЯЦИЯ ПЕРЕРАСПРЕДЕЛЕНИЕ КЛЕТОК 117
веденных с помощью цейтраферной съемки. Их фильм показал, что цилиндрические клетки вегетативной пластинки утрачивают свой контакт с другими клетками и с гиалиновым слоем: это изменение приводит к увеличению поверхности клеточного пласта. Авторы полагают, что очень плотный контакт между клетками вегетативной пластинки по их внутренней поверхности вызывает изгиб пластинки внутрь, а не наружу. Вторая фаза инвагинации Инвагинация клеток вегетативной половины разделяется на две отчетливо различающиеся фазы. После короткой паузы начинается вторая фаза формирования архентерона. В течение этой фазы происходит чрезвычайно резкое удлинение архентерона, его длина почти утраивается, и короткий широкий зачаток архентерона трансформируется в длинную тонкую трубку; однако при этом не заметно, чтобы формировались новые клетки. Такое растяжение обусловлено перераспределением его клеток посредством миграции одних клеток по другим и их уплощения (Ettensohn. 1985: Hardin. Cheng. 1986). У некоторых (но не у всех) видов морских ежей (Schroeder, 1981; Trinkaus, 1984) направление, в котором удлиняется гастроцель, может быть задано клетками вторичной мезенхимы,которые формируются на верхушке архентерона и остаются там (рис. 4.11 ). Филоподии этих клеток, простираясь через жидкость, содержащуюся в бластоцеле, устанавливают контакт с поверхностью его внутренней стенки. Они прикрепляются к стенке в промежутках между клетками бластодермы и затем укорачиваются. Когда передний край архентерона приближается к стенке бластоцеля в анимальной области, клетки
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 118 ГЛАВА 4 вторичной мезенхимы рассеиваются в бластоцеле. где происходит их пролиферация, необходимая для формирования ими мезодермальных органов. На месте контакта архентерона со стенкой бластоцеля со временем формируется ротовое отверстие, которое, сливаясь с архентероном. образует непрерывную пищеварительную трубку. Таким образом, бластопор, как это характерно для вторичноротых, маркирует положение ануса. При гаструляции у морского ежа наблюдается сочетание нескольких процессов, а именно иммиграции мезенхимных клеток, независимой инвагинации клеток вегетативной пластинки и дальнейшей инвагинации архентерона, опосредованной перераспределением клеток эпителиального пласта. Гаструляция у амфибий Изучение гаструляции у амфибий является одной из старейших и вместе с тем одной из новейших областей экспериментальной эмбриологии; гаструляция у амфибий широко изучалась в течение прошлого столетия, однако большая часть наших теорий, касающихся механизмов этих морфогенетических движений, была пересмотрена в семидесятые годы. Изучение гаструляции у амфибий осложняется тем, что строение зародышей бесхвостых и хвостатых амфибий на этих стадиях несколько различается и они используют разные средства для достижения одной и той же цели (Smith. Malacinski. 1983: Lundmark. 1986). В последние годы наиболее интенсивные исследования проводились на Xenopus laevis (гладкой шпорцевой лягушке), поэтому мы сконцентрируем внимание на способе гаструляции у этого вида. Подготовка клеток к гаструляции осуществляется в период дробления. Как упоминалось в гл. 3, у амфибий на стадии перехода к средней бластуле происходит перестройка клеточного цикла, он замедляется (в результате включения в него фаз G1 и G2), деления клеток становятся асинхронными, клетки приобретают способность перемещаться, и впервые в жизни животного в ядрах клеток происходит транскрипция новых мРНК. У Xenopus laevis эта перестройка начинается непосредственно после 12-го деления дробления (Newport. Kirschner. 1982). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|