
|
|
Уравнение состояния идеального газа
Законы Бойля-Мариотта и Гей-Люссака могут быть объединены в одно общее математическое уравнение идеального газа, связывающее три величины: давление, объем и температуру газа. Впервые в 1834 г. пришел к выводу о существовании для газов некоторой универсальной функции французский ученый Бенуа Поль Эмиль Клапейрон (1799—1864). В более общем виде уравнение состояния идеальных газов было выведено Д. И. Менделеевым в 1874 г. Поэтому это уравнение носит название уравнения Клапейрона-Менделеева. Оно может быть выведено из кинетической теории газов (1.8). Подставив в уравнение (1.9) уравнения (1.10) и преобразовав их, получаем В этом уравнении выражение Величину Согласно уравнению состояния идеального газа универсальная газовая постоянная для одного моля может быть выражена так:
При этом произведение PV представляет собой работу газа при увеличении его объема от 0 до V против внешнего давления и при повышении температуры на 1°. Поэтому величина газовой постоянной должна выражаться в единицах энергии, отнесенной к 10С. Удельная газовая постоянная (отнесенная к единице массы газа) для смеси газов может быть определена, руководствуясь законом аддитивности (правилом смешения), т. е.
где Уравнение PV = RT относится к одной грамм-молекуле. Обозначив молекулярную массу через М, получим для 1 кг (г) газа
а для m кг (г) газа: Пользуясь приведенным уравнением, можно вычислить любую из входящих в него величин по известным остальным. Закон Авогадро
Итальянский ученый Амадео Авогадро (1776—1856) в начале XIX в. развил предположение, что в равных объемах любых газов, взятых при одинаковой температуре и одинаковом давлении, содержится одинаковое число молекул, или равное число молекул любых газов занимает один и тот же объем при нормальных условиях. Экспериментально установлено и теоретически доказано, что грамм-молекула любого газа при нормальных условиях занимает объем 22,414 л (округленно 22,4). Этот объем называется грамм-молекулярным, или молярным объемом (число Авогадро). В середине XIX в. это предположение в связи с развитием кинетической теории было подтверждено экспериментально, и гипотеза Авогадро получила силу закона. Закон Грейама (Грэма)
В 1829 г. известный английский химик Томас Гренам (1805-1869), изучая диффузию газов, установил, что скорость диффузии газа обратно пропорциональна корню квадратному из его плотности. Распространяя этот закон на истечение газа из малых отверстий, закон Грейама гласит, что при одинаковых давлениях и температурах скорости истечения разных газов ω из малых отверстий обратно пропорциональны корням квадратным из их плотности ρ, т. е.
На этом законе, в частности, основано определение плотности газов в эффузиометре, по времени истечения одинаковых объемов исследуемого газа и воздуха. Естественно, что время истечения газов τ через отверстие эффузиометра обратно пропорционально скоростям истечения этих газов ω или прямо пропорционально корням квадратным из их плотности ρ
Кроме указанного, из закона Грейама можно сделать ряд и других выводов. В частности, масса газа, вытекающего из отверстия сечением S, в единицу времени будет равна Работа, затрачиваемая на истечение газа через малые отверстия, будет выражаться
где Р1 - давление газа в емкости; Р2 - давление газа в пространстве, куда поступает газ по истечении через малое отверстие. Учитывая, что работа, затраченная на истечение газа через малые отверстия, равна потере живых сил, т. е.
Закон Дальтона В 1802 г. английский химик и физик Джон Дальтон (1766— 1844) опубликовал закон парциальных давлений, согласно которому давление газовой смеси равно сумме давлений, производимых каждым компонентом в отдельности, т.е. Таким образом, в. смеси газов каждый компонент ведет себя независимо от других, а следовательно, он сохраняет все свои физические свойства независимо от количества компонентов, находящихся в этой смеси. Каждый из компонентов, входящих в газовую смесь, имеет свою упругость (давление), которая называется парциальным давлением. Поэтому закон Дальтона можно сформулировать еще так: общее давление смеси газов равно сумме парциальных давлений компонентов, входящих в эту смесь. Объём каждого компонента равен общему объему смеси, но, занимая весь объем смеси, каждый компонент имеет свою упругость, т. е. находится под своим парциальным давлением. Парциальный объем, т. е. объем каждого компонента, приведенный к общему давлению, можно определить по закону Бойля-Мариотта, а именно:
откуда Сумма парциальных объемов равна общему объему что видно из следующего уравнения: Из приведенного выше уравнения можно определить не только парциальный объем, но и парциальное давление:
Отношение Объемная концентрация компонента в газовой смеси равна
Закон Рауля Углеводородные жидкости образуют друг с другом так называемые идеальные растворы, т. е. растворы, в которых компоненты полностью растворимы. Растворение газа в жидкости происходит до тех пор, пока парциальное давление газа не сравняется с парциальным давлением жидкости. Этот момент равенства парциальных давлений соответствует так называемому равновесному состоянию (равновесию фаз). Французский химик Франсуа Мари Рауль (1830—1901) установил, что парциальное давление pt любого компонента в жидкой смеси равно молекулярной концентрации его в жидкости хi , умноженной на упругость его паров θi в чистом виде при данной температуре, т. е.
Общее давление или упругость паров жидкости Р, состоящей из нескольких компонентов, равно сумме парциальных давлений этих компонентов
При равновесии фаз, т. е. когда парциальное давление компонента в паровой фазе (над жидкостью) и в жидкой фазе (в жидкости) будут одинаковы, закон Рауля примет следующий вид: где Зная состав жидкой смеси, по приведенному уравнению равновесия фаз легко определить состав пара, находящегося в равновесии с нею:
или состав жидкой смеси
Из приведенного уравнения следует, что
Константы равновесия k отдельных компонентов зависят от температуры и давления и берутся, как правило, из специально составленных графиков. Применение сжиженного газа, его транспортирование и хранение основаны на законе Рауля. Закон Генри В 1803 г. английский химик Уильям Генри (1775—1836) для газов, не действующих химически на жидкость, предложил известный теперь под его именем закон, согласно которому при постоянной температуре весовое количество газа, растворяющегося в жидкости, прямо пропорционально абсолютному давлению над жидкостью. Или иначе: при постоянной температуре весовая концентрация газа в растворе пропорциональна его давлению:
где g – весовая концентрация газа в растворе, Р – давление, к – постоянная Генри, или коэффициент растворимости. Количество газа, которое может раствориться в той или иной жидкости, зависит от характера этой жидкости и газа, от температуры, давления и присутствия в растворе других растворенных веществ. Растворимость газа в жидкости принято выражать так называемым бунзеновским коэффициентом, представляющим собой объем приведенного к нормальным условиям газа, растворяющегося в одном объеме жидкости при том же давлении. Если в жидкости растворено несколько газов, то весовая концентрация g каждого из них в растворе пропорциональна упругости его паров (парциальному давлению) в газовой фазе при установившемся равновесии. Растворимость газов характеризуется коэффициентом растворимости β и коэффициентом абсорбции α. Первый представляет собой число объемов газа, при данных условиях, растворившихся в одном объеме жидкости; втором коэффициент — число объемов газа, при нормальных условиях, поглощаемых одним объемом жидкости при парциальном давлении газа, равном 760 мм рт. ст. Концентрацию растворенного газа в жидкости часто выражают в граммах или миллиграммах газа в 1 л жидкости или в объемах растворенного газа в одном объеме растворителя. Закон Генри применим в том случае, когда газ в жидкости растворяется в незначительных количествах и давление газа над жидкостью незначительно. При значительней растворимости газа в жидкости его концентрация может быть определена в соответствии с законом Рауля. Растворимость ограниченно растворимых газов в жидкостях, находящихся под большим давлением, может быть рассчитана по уравнению И.Р.Кричевского и Я.С.Казарновского:
где f - летучесть растворенного газа при давлении, равном общему давлению Р; υ’- кажущийся парциальный объем растворенного газа при бесконечном разбавлении (принимается не зависящим от давления); Р - давление пара чистого растворителя; k - константа Генри. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
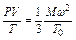 .
. для данного количества исследуемого газа является постоянной величиной: отнесенное к 1 грамм-молекуле, оно будет одинаковым для всех газов, так как грамм-молекула любого газа при нормальных условиях занимает один и тот же объем.
для данного количества исследуемого газа является постоянной величиной: отнесенное к 1 грамм-молекуле, оно будет одинаковым для всех газов, так как грамм-молекула любого газа при нормальных условиях занимает один и тот же объем. . (22)
. (22) ,
,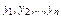 -содержание отдельных компонентов газа в смеси (мольная концентрация в долях единицы); R1, R2,..., Rn—удельные газовые постоянные отдельных компонентов газа, входящих в смесь, т. е.
-содержание отдельных компонентов газа в смеси (мольная концентрация в долях единицы); R1, R2,..., Rn—удельные газовые постоянные отдельных компонентов газа, входящих в смесь, т. е.  .
. ,
, .
. .
. .
. . (1.11)
. (1.11) , (1.12)
, (1.12) , подставив в выражение (1.12) значения т из уравнении (1.11) и произведя соответствующие преобразования, получим
, подставив в выражение (1.12) значения т из уравнении (1.11) и произведя соответствующие преобразования, получим .
. .
.
 .
. ,
, .
. .
. , т. е. отношение парциального объема к общему объему, есть объемная или молекулярная концентрация, которую для газовой и паровой фаз обычно обозначают буквой у. Таким образом, парциальное давление компонента
, т. е. отношение парциального объема к общему объему, есть объемная или молекулярная концентрация, которую для газовой и паровой фаз обычно обозначают буквой у. Таким образом, парциальное давление компонента  в газовой или паровой фазе равно произведению его объемной или молекулярной (молярной) концентрации
в газовой или паровой фазе равно произведению его объемной или молекулярной (молярной) концентрации 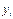 , на общее давление (P):
, на общее давление (P): .
. .
. .
. .
. .
.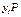 —парциальное давление в паровой (газовой) фазе (согласно закону Дальтона);
—парциальное давление в паровой (газовой) фазе (согласно закону Дальтона);  — парциальное давление в жидкой фазе (согласно закону Рауля).
— парциальное давление в жидкой фазе (согласно закону Рауля). ,
, .
.


 или
или  ,
, ,
,