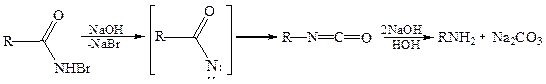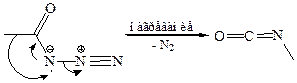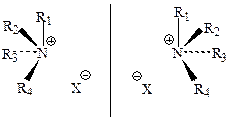|
|
Получение алифатических аминов1.1.1Аммонолиз спиртов в присутствии катализаторов дегидратации (AI2O3, SiO2, ThO2 и т. п.) при 300–500 оС, в результате образуется смесь первичных, вторичных и третичных аминов:
1.1.2При взаимодействии аммиака с галогеналканами или другими алкилирующими реагентами получают соли аммония и амины. На первой ступени реакции образуются соли алкиламмония, которые при взаимодействии с аммиаком в равновесной реакции образуют алкиламин:
1.1.3Аммонолиз эпоксидов:
1.2 Получение циклических аминов:
Реакции восстановления 2.1 Восстановление нитросоединений. В качестве восстановителя используются Sb, HCl / Pt. Алюмогидрид лития восстанавливает алифатические нитросоединения (Alk–NО2) до аминов, а ароматические нитросоединения (Ar–NО2) – до азосоединений (Ar–N=N–Ar). 2.1.1 Реакция Бешона:
Синтез Зайцева
2.1.3 Реакция Зинина (1842 г):
2.1.4 Восстановление нитрилов. В качестве восстановителя используют H2 в присутствии катализатора, восстановление идет через промежуточный имин RCHNH:
2.1.5 Восстановление амидов:
2.2 Восстановление оксимов:
2.3 Восстановительное аминирование карбоксильных соединений. Для получения высших алкиламинов используют соответствующие жирные кислоты:
2.4 Реакция Лёйкарта–Валлаха (1949 г).Вторичные и третичные амины можно получить восстановительным аминированием альдегидов и кетонов под действием первичных или вторичных аминов и муравьиной кислоты:
2.5 Метилирование по Эшвайлеру–Кларку (1905 г). Реакция является разновидностью восстановительного аминирования – метилирование вторичных и первичных аминов действием формальдегида и муравьиной кислоты:
3. Реакция Лейкарта. В результате нагревания альдегидов и кетонов с муравьинокислым аммонием образуется первичный амин:
4.Реакция взаимодействия параформа с хлористым аммонием. При взаимодействии параформа, деполимеризующегося в реакции в формальдегид, с хлористым аммонием, образующиеся метилольные производные аммиака восстанавливаются формальдегидом в амины:
5. Реакции замещения. Для получения анилина аммиак арилируют, нагревая его с хлорбензолом в присутствии оксида меди (I):
Специальные методы 6.1 Расщепление амидов карбоновых кислот галогенами (перегруппировка Гофмана, 1850 г.). В результате взаимодействия амидов алифатических и ароматических карбоновых кислот с щелочным раствором галогена получают первичные амины, при этом углеродная цепь укорачивается:
Механизм реакции Гофмана включает в себя две стадии. На первой стадии происходит катализируемое щелочью бромирование амида по атому азота:
Под действием щелочи бромамид образует неустойчивый ацилнитрен, который перегруппировывается в изоцианат, гидролизующийся в первичный амин:
6.2 Перегруппировка Курциуса. Хлорангидриды кислот, взаимодействуя с азидом натрия NaN3, дают ацилазиды (азиды кислот), которые при нагревании превращаются в изоцианаты:
Превращение ацилазидов в изоцианаты, представляет собой согласованный процесс (перегруппировка Курциуса):
Образовавшиеся изоцианаты реагируют с водой и образуются амины:
7. Гидрирование азаметинов (оснований Шиффа):
8. Декарбоксилирование аминокислот:
9. Перегруппировка Бекмана. При действии кислых агентов (РСI5, H2SO4, РОСI3 и др.) на оксимы кетонов наблюдается т. н. перегруппировка Бекмана – превращение оксимов в амиды, которая может быть использована в ряде случаев для получения аминов:
Механизм перегруппировки Бекмана:
Фактически одновременно с отщеплением воды идет миграция радикала R (вместе с электронной парой связи), расположенного со стороны, противоположной уходящей молекуле воды. Образующийся карбкатион стабилизируется присоединением молекулы воды, давая амид, который после гидролиза превращается в первичный амин. Физические свойства аминов.Низшие алифатические амины – газообразные, легко воспламеняющиеся вещества, средние – жидкие, высшие – твердые соединения. Запах низших аминов сходен с запахом аммиака. Высокомолекулярные амины обладают характерным запахом рыбы. Первичные и вторичные амины образуют межмолекулярные водородные связи и имеют температуры кипения выше, чем соответствующие им неполярные соединения. Однако водородные связи в аминах не столь прочны, как в спиртах и карбоновых кислотах, поэтому амины ассоциированы меньше и кипят при более низких температурах, чем спирты с близкой молекулярной массой. Третичные амины не имеют водородных атомов и не образуют водородные связи, поэтому их температуры кипения близки к таковым неполярных соединений (таблица 5). Низшие алифатические амины легко растворимы в воде, что также обусловлено образованием водородных связей с молекулами воды. У высших членов гомологического ряда растворимость в воде уменьшается по мере увеличения алкильного радикала. Амины растворяются и в менее полярных растворителях – эфирах, спиртах, бензоле.
Таблица 5 – Физические свойства некоторых аминов
Строение аминов.Алифатические амины, являясь производными аммиака, также имеют пирамидальное строение с атомом азота в вершине пирамиды. Углы между связями C–N–C в среднем равны 106–108°, т. е. атом азота в алкиламинах в стереохимическом отношении подобен sр3 гибридизованному атому углерода. НЭП алкиламинов занимает четвертую пространственно направленную орбиталь sp3 типа:
Если в третичных аминах атом азота связан с различными заместителями (R1R2R3N), то он является асимметрическим (хиральным). В этом случае возможно существование двух энантиомеров, причем роль четвертого заместителя выполняет НЭП:
Однако энантиомеры такого типа не выделены в чистом виде, так как переход одной конфигурации в другую (инверсия) протекает очень быстро даже при комнатной температуре. Таким образом, алифатические амины конфигурационно неустойчивы и оптически неактивны. В отличие от аминов четырехзамещенные соли аммония в стереохимическом отношении являются полными аналогами хиральных углеродных соединений, т. е. могут существовать в виде конфигурационно устойчивых оптически активных энантиомеров с хиральным атомом азота:
Если в алифатических аминах взаимное влияние аминогруппы и углеводородного радикала передается посредством индуктивного эффекта, то в ароматических аминах существенную роль играют эффекты сопряжения. Строение ароматических аминов, например, анилина, представляют посредством резонансных структур:
Сопряжение оказывает заметное влияние на прочность связи C–N ароматических аминов. Она, как и следовало ожидать, у них (у трех из четырех предельных структур связь C–N является двойной) выше по сравнению со связью C–N алифатических аминов. Влияние сопряжения в данном случае аналогично тому, которое наблюдалось в С–О связях спиртов и фенолов (табл. 6). Связи C–N и N–H менее прочные, чем связи С–О и О–Н, что указывает на более полярный характер или больший процент ионной составляющей по Полингу для последних.
Таблица 6 – Энергия химических связей аминов, спиртов, фенолов

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|