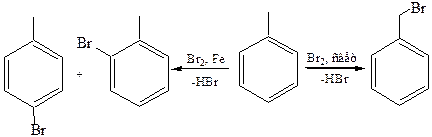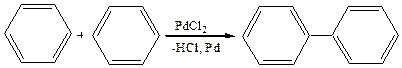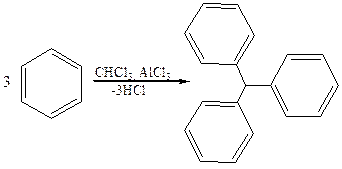|
|
Реакции гомологов бензола
6.2 Галогенирование:
Экологическое послесловие.Загрязнение атмосферы городов летучими ароматическими углеводородами (АУ) связано, в основном, с движением автотранспорта и составляет 50 % от общего загрязнения городского воздуха. Значительную роль в загрязнении окружающей среды АУ играют лесные пожары, так как в составе дыма содержатся бензол, толуол и ксилолы. Ароматические углеводороды в атмосфере могут разрушаться путем фотохимического окисления. В воде и почве АУ легко разрушаются микроорганизмами, а также легко испаряются в атмосферу, что объясняет сравнительно короткий период острого токсического действия нефти. Жидкие АУ обладают сильным местным раздражающим эффектом, причем интенсивность эффекта уменьшается с увеличением числа алкильных радикалов и их удлинением, усиливаясь с увеличением разветвленности и ненасыщенности радикалов. Бензол и его гомологи, являясь неполярными или слабо полярными веществами, обладают липофильными свойствами, поэтому они имеют сродство к тканям, богатым липидами. В условиях острого отравления поражают центральную нервную систему, вызывая наркотический эффект, а при более высоких концентрациях – судороги и кому (смерть наступает от паралича дыхательного центра). Выведение АУ из организма человека происходит с выдыхаемым воздухом и в виде водорастворимых веществ – конъюгатов с глюкуроновой и серной кислотами. Бензол при внесении в почву может проникать во все сельскохозяйственные культуры, при этом некоторые растения (пшеница и свекла) являются его концентраторами. Хроническая бензольная интоксикация возникает при длительном контакте даже с небольшими концентрациями бензола в воздухе или при попадании его на кожу. Она характеризуется, в основном, поражением кроветворных органов, отмечается также патология центральной нервной и других систем. В организме бензол концентрируется, в основном, в костном мозге и жировой ткани. Его окисление происходит в печени и костном мозге. Первой стадией биотрансформации является образование под действием ферментов (оксидаз) эпоксидов. Основным продуктом дальнейшего окисления является фенол, но образуются также гидрохинон, пирокатехин, гидроксигидрохинон и муконовая кислота. Толуол. В почве толуол активно разлагается микроорганизмами до бензилового спирта, бензальдегида и, в конечном итоге, бензойной кислоты. Для человека толуол – яд общетоксического действия, вызываю-щий острые и хронические отравления. Наркотизирующий и раздражаю-щий эффекты у толуола более выражены, чем у бензола. Проникая в организм, он вызывает эндокринные нарушения, изменяет проницаемость клеточных мембран. Накапливается толуол преимущественно в ЦНС. Биотрансформация происходит под действием ферментов (оксидаз) эндоплазматического ретикулума гепатоцитов. Большая часть толуола окисляется в бензойную кислоту, а затем в виде гиппуровой кислоты или конъюгата с глюкуроновой кислотой выводится с мочой. Небольшая часть толуола окисляется в о-, м- и п-крезолы (происходит гидроксилирование кольца), которые в виде конъюгатов с серной и глюкуроновой кислотами выводятся из организма.
ПОЛИЦИКЛИЧЕСКИЕ АРЕНЫ С ИЗОЛИРОВАННЫМИ КОЛЬЦАМИ Обособленные кольца могут быть как непосредственно связанными друг с другом, образуя ансамбли колец (например, дифенил), так и разделенными алифатическими цепями (например, дифенилметан).
ГРУППА ДИФЕНИЛА Номенклатура и строение.К этой группе относятся соединения, содержащие два или более бензольных кольца непосредственно связаные между собой одной σ-связью, например, терфенил:
При образовании названий веществ, относящихся к этой группе, руководствуются следующими правилами. Номерами обозначают атомы углерода одного кольца, в другом кольце (кольцах) атомы углерода обозначают цифрами со штрихами. Места соединения колец обозначают наиболее низкими цифрами. Количество бензольных колец в ансамбле обозначают числительными – префиксами (3 –тер-, 4 –кватер-, 5 –квинки- и т.д.), прибавляя их к названию фенил (терфенил, кватерфенил). Молекула дифенила обладает свободным вращением вокруг центральной связи. В кристаллическом состоянии бензольные кольца копланарны (лежат в одной плоскости) и сопряжены друг с другом (π, π-сопряжение), в то время как в растворах и в газовой фазе плоскости колец наклонены относительно друг друга:
Этот поворот можно объяснить отталкиванием перекрывающихся заполненных орбиталей С–Н-связей соседних колец. Физические свойства.Дифенил – бесцветное кристаллическое вещество, термически очень устойчивое. Он хорошо растворим в спирте, эфире, бензоле и других органических растворителях, нерастворим в воде и других полярных растворителях. Методы получения. 1. Дегидрирование бензола при 800 °С в присутствии катализатора (Ni, Fe):
2. Реакция Вюрца:
3. Димеризация бензола в присутствии солей Pd:
4. Реакция Ульмана. Протекает при нагревании до 200–250 оС в присутствии медного порошка:
Химические свойства.Дифенил является типичным ароматическим углеводородом, в реакции электрофильного замещения вступает легче, чем бензол. Фенильное кольцо, являясь заместителем I рода, ориентирует электрофильные заместители в пара-положение (фенильный радикал создает пространственные затруднения при замещении в opтo-положение). ЭА электрофильная частица, «вставшая» в кольцо, дезактивирует его, и следующая электрофильная частица вступает в пара-положение другого кольца:
Если в кольце дифенила имеется заместитель I рода (ЭД), то электрофильная частица атакует активированное положение этого же кольца. Применение.Дифенил используют в производстве красителей, негорючих трансформаторных масел. Благодаря высокой химической и термической стабильности, а также низкой температуре плавления дифенил в смеси с другими веществами применяется как высокотемпературный теплоноситель, а также в качестве охлаждающей жидкости в ядерных реакторах. ФЕНИЛМЕТАНЫ. Строение.К фенилметанам относят многоядерные соединения, в которых бензольные кольца разделены одним атомом углерода. Такие углеводороды рассматривают как производные метана, у которого один или несколько атомов водорода замещены на фенильные радикалы. По степени замещенности их можно расположить в следующий ряд:
Следует отметить, что у первых трех соединений связь С–Н разрыхлена σ, π-сопряжением, причем у трифенилметана эта связь наименее прочная, так как участвует в сопряжении с тремя фенильными радикалами, что является одной из причин легкого замещения атома водорода. Ди- и трифенилметан и их производные могут вступать как в ионные, так и в радикальные реакции. В ди- и трифенилметанах центральный атом углерода находится в sp3 гибридизации, и бензольные кольца, располагаясь на расстоянии двух σ-связей одно от другого, находятся не в одной плоскости и не сопряжены друг с другом. В случае образования катиона, аниона или радикала структура приобретает более плоское строение, и возникает единая сопряженная система. При этом негибридизованная pz орбиталь центрального атома углерода (sp2 гибридизация) вступает в сопряжение с тремя бензольными кольцами, образуя единую π-МО. Физические свойства.Ди- и трифенилметаны – бесцветные кристаллические вещества, нерастворимые в воде, но хорошо растворимые в спирте, диэтиловом эфире, хлороформе. Способы получения. 1. В промышленности фенилметаны получают реакцией Фриделя–Крафтса в присутствии катализаторов – кислот Льюиса: 1.1
1.2
1.3
Химические свойства 1. Свойства по центральному атому углерода. Особые свойства поведения (по сравнению с метаном) обусловлены подвижностью С–Н связи в алифатической части молекулы, что обусловлено, с одной стороны, σ, π-сопряжением с бензольными кольцами, а с другой эффективной дело-кализацией отрицательного и положительного зарядов и неспаренного электрона в ди- и трифенилметановой системе при образовании соответственно аниона, катиона и радикала. 1.1 Кислотные свойства. Образующийся анион очень устойчив за счет делокализации отрицательного заряда по бензольным кольцам, и поэтому С–Н-кислотность фенилметанов возрастает с увеличением числа колец. 1.2 Реакция с амидом натрия:
Реакция смещается в сторону более слабой кислоты (аммиака), и раствор приобретает ярко-красную окраску, обусловленную наличием единой сопряженной системы в образующемся карбанионе трифенилметилнатрия. 1.3 Взаимодействие с щелочными металлами:
2. Реакции радикального замещения:
3. Свойства по ароматическим кольцам. Центральный атом углерода за счет σ, π-сопряжения нагнетает электронную плотность в бензольные кольца, обогащая орто- и пара-положения:
Наклонить
Применение. Дифенилметан является растворителем в лакокрасочной промышленности, обладает фунгицидной и бактерицидной активностью с широким спектром действия. Дифенилметан применяют и как отдушку для мыла. Трифенилметан используют в качестве стабилизатора к различным видам топлива и полимеров, а также в качестве красителей. Ди- и трифенилметановые красители и их производные представляют собой старейший класс синтетических красителей, большинство из которых открыты в конце XIX и начале XX в. Эти красители отличаются исключительной яркостью, высокой красящей силой, но, обладают низкой светопрочностью. Основные трифенилметановые красители применяют для крашения бумаги, изготовления цветных карандашей. Некоторые из них являются индикаторами (метиловый фиолетовый) и антисептиками (бриллиантовый зеленый – «зеленка»). Фиолетовый К применяют в производстве паст для шариковых ручек, копировальных бумаг и лент для пишущих машинок. Пара-розанилин и его мета-метилпроизводные (фуксины) встречаются в природе и придают окраску некоторым цветам (фуксии). Фуксины применяются для окрашивания нетекстильных материалов (бумаги, кожи, дерева), приготовления чернил, полиграфических лаков. Водный раствор фуксинсернистой кислоты является аналитическим реагентом на альдегидную группу.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 6.1 Реакции окисления:
6.1 Реакции окисления: