
|
|
Зонная теория электропроводности.12 Строение вещества. Виды связи Химическая связь Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные связи (межмолекулярные взаимодействия). Химические связи - связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь. Межмолекулярные связи - связи между молекулами. Это водородная связь, ион-дипольная связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольная (за счет образования этой связи объединяются молекулы полярных веществ, например, в жидком ацетоне) и др. Ионная связь - химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях двух элементов) она образуется в случае, когда размеры связываемых атомов сильно отличаются друг от друга: одни атомы большие, другие маленькие - то есть одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы и атомы элементов, образующих типичные неметаллы); электроотрицательность таких атомов также сильно отличается. Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
По числу общих электронных пар ковалентные связи делятся на · простые (одинарные) - одна пара электронов, · двойные - две пары электронов, · тройные - три пары электронов. Двойные и тройные связи называются кратными связями. По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную. Неполярная связь образуется между одинаковыми атомами, полярная - между разными. Электроотрицательность - мера способности атома в веществе притягивать к себе общие электронные пары. По характеру перекрывания электронных облаков ("орбиталей") ковалентная связь делится на Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью. Гибридизация атомных орбиталей и электронных облаков - предполагаемое выравнивание атомных орбиталей по энергии, а электронных облаков по форме при образовании атомом ковалентных связей. Металлическая связь - химическая связь, образованная за счет обобществления валентных электронов всех связываемых атомов металлического кристалла. В результате образуется единое электронное облако кристалла, которое легко смещается под действием электрического напряжения - отсюда высокая электропроводность металлов. Водородная связь - межмолекулярная связь, образованная за счет частичного акцептирования пары электронов высокоэлектроотрицательнного атома атомом водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле есть атом с неподеленной парой электронов и высокой электроотрицательностью (F, O, N), а в другой - атом водорода, связанный сильно полярной связью с одним из таких атомов. Примеры межмолекулярных водородных связей: H—O—H ··· OH2, H—O—H ··· NH3, H—O—H ··· F—H, H—F ··· H—F. Внутримолекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и др. Мерой прочности любой связи является энергия связи. Энергии ионной и ковалентной связи - одного порядка, энергия водородной связи - на порядок меньше. Энергия ковалентной связи зависит от размеров связываемых атомов (длины связи) и от кратности связи. Чем меньше атомы и больше кратность связи, тем больше ее энергия. Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи. Строение вещества По типу строения все вещества делятся на молекулярные и немолекулярные. Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярные. По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы). Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах. Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях. Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия и пр.) Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na+)2(SO42-), (K+)3(PO43-), (NH4+)(NO3-) и т. д. Ковалентными связями связаны атомы, из которых состоят сложные ионы. Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb). Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов). В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы ("кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ),молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические(кристаллы веществ с металлической связью). Зонная теория электропроводности. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
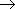 H:H
H:H

 N
N



 + и
+ и  .
. -связь и
-связь и  -связь.
-связь.