
|
|
Краткие сведения о сущности процессаЭкстракцией обычно называют избирательное извлечение соединений металлов (или других элементов) из водных растворов в несмешивающуюся с ними жидкую фазу, как правило, органическую. Способность вещества переходить из водной фазы в органическую характеризуется коэффициентом распределения, который равен отношению равновесных концентраций вещества в органической и водной фазах:
Величина коэффициента распределения зависит от химических свойств экстрагируемого соединения, свойств растворителя, кислотности и солевого состава водного раствора, температуры, а также, в большинстве случаев, от концентрации ионов металлов в растворе. Поэтому более полно распределение вещества между водной и органической фазами характеризует константа равновесия реакции экстрагирования. При использовании активностей всех участвующих в реакции веществ константа равновесия зависит только от температуры. В качестве экстрагентов применяют самые разнообразные органические соединения: углеводороды, эфиры, кетоны, спирты, различные органические кислоты и основания. В зависимости от характера взаимодействия экстрагируемого вещества и органического растворителя различают следующие типы экстракции: 1. Экстракция без изменения химического состава при переходе из водной фазы в органическую. По этому типу экстрагируются ковалентные молекулы (например, экстракция йода CCl4), а также недиссоциированные в водном растворе молекулы слабых кислот и оснований (например, экстракция уксусной кислоты бензолом). 2. Экстракция, сопровождающаяся катионным или анионным обменом между органической и водной фазами. К катионному обмену способны органические кислоты, обменивающие свой водород на катион (простой или сложный) металла. Уравнение катионообменной экстракции имеет вид:
где HRо – органическая кислота. При катионообменной экстракции ион водорода переходит в водную фазу, повышая ее кислотность. Поэтому добавление кислоты в водный раствор смещает равновесие в обратную сторону, т.е. экстракция ухудшается. В качестве экстрагентов – катионообменников чаще всего применяют жирные (карбоновые) кислоты: CnH2n+1COOH и кислые эфиры фосфорной кислоты (алкилфосфорные кислоты) (CnH2n+1)H3-xPO4 , где х = 1 или 2. Примером использования алкилфосфорной кислоты является экстракция молибдена, образующего в растворе при рН = 5 оксикатионы
(к молекуле Экстрагенты, используемые для анионообменной экстракции, представляют собой органические основания или их соли, обменивающие гидроксил или анион кислоты на анион, образованный извлекаемым металлом. Наиболее распространенным видом анионообменных экстрагентов являются соли производных аммиака или иона аммония – соли аминов В качестве примера анионообменной экстракции можно привести экстракцию рения триоктиламином:
где R = C8H17. 3. Экстракция, сопровождающаяся присоединением молекул экстрагента к молекуле экстрагируемого вещества с образованием комплексного (координационного) соединения. Этот тип экстракции наиболее сложен и многообразен. Он характерен для, так называемых, «нейтральных» экстрагентов, обычно не склонных к катионному или анионному обмену. Эти экстрагенты имеют активную группу – атом, имеющий неразделенные электронные пары и заметный дипольный момент. Такие группы, подобно атому в аммиаке, склонны присоединять протоны (образование иона аммония в случае аммиака), а также образовывать координационные («комплексные») соединения (подобно тому, как образуются аммиачные комплексы меди). К «нейтральным» экстрагентам относятся спирты, простые и сложные эфиры, кетоны, содержащие активный атом кислорода. Один из наиболее распространенных в промышленности РФ экстрагентов – трибутилфосфат, который относится именно к этому виду экстрагентов. Он представляет собой сложный эфир фосфорной кислоты: С4Н9 – О С4Н9 – О Р = О С4Н9 – О Активным является кислород, связанный только с атомом фосфора (группа Р = О). В зарубежной практике распространен другой нейтральный экстрагент – метилизобутилкетон (МИБК): С4Н9 С = О С4Н9 также содержащий активный кислород (группа С = О). Примеры экстракции с присоединением нейтральных экстрагентов: 1. Экстракция тантала трибутилфосфатом. Поскольку кислород воды склонен к образованию водородных связей, в воде присутствуют ионы оксония [H3O·3H2O·3ТБФ] Образование такого катиона установлено при экстракции тантала трибутилфосфатом. В этом случае экстрагируемое соединение имеет состав: [H3O·3H2O·3ТБФ]+ ТаF5 ; [H3O·3H2O·3ТБФ]+ НТаF7
2. Экстракция молибдена трибутилфосфатом из солянокислых растворов. В солянокислых растворах молибден присутствует в виде нейтральных молекул. Например, MoO2Cl2. Наиболее характерно для молибдена координационное число 6. При экстракции молибдена трибутилфосфатом координационно-насыщенная молекула образуется благодаря присоединению двух молекул ТБФ к катиону молибдена: MoO2·Cl2·2ТБФ Можно полагать, что при экстракции молибдена из сернокислых растворов также образуется подобное соединение [МоO2SО4·2ТБФ] Цель работы состоит в изучении зависимости коэффициента распределения молибдена при экстракции его трибутилфосфатом из сернокислых растворов от концентрации ионов водорода в интервале рН=1-4 и концентрации молибдена в исходном растворе.
Проведение опыта 20-25 мл раствора Na2MoO4 (концентрация Мо = 1, 5 или 10 г/л), подкисленного серной кислотой до рН = 1, 3 или 4, пипеткой перенести в сухую чистую делительную воронку и добавить равный объем ТБФ. Воронку накрыть пробкой и проводить встряхивание в течение 15 мин. Затем вынуть воронку из встряхивателя и поставить в штатив до полного расслоения фаз. После отстаивания слить нижний водный слой в сухой чистый стакан емкостью 50 мл. Органическую фазу слить в мерный цилиндр и зафиксировать ее объем. Рассчитать объем равновесной водной фазы по разности между суммой объемов исходного раствора и ТБФ, и объемом равновесной органической фазы. Органическую фазу из мерного цилиндра опять слить в специальную емкость (для последующей регенерации ТБФ). Измерить рН равновесной водной фазы (рафината), перенести ее в мерную колбу емкостью 50 мл и определить содержание молибдена.
Определение молибдена в рафинатах Молибден в рафинатах определяют калориметрическим методом, основанным на образовании V-валентным молибденом окрашенного роданидного комплекса. Для определения содержания молибдена в рафинате рассчитаную аликвотную часть раствора из мерной колбы емкостью 50 мл перенести в мерную колбу емкостью 100 мл. Добавить 24 мл H2SO4 (1:2), 3 мл раствора (NH4)2Fe(SO4)2 , 6 мл CuSO4 , 18 мл раствора тимочевины и через 5 мин – 3,5 мл раствора роданистого аммония. Довести объем дистиллированной водой до метки, перемешать и через 10 мин провести калориметрирование на фоне холостой пробы (в колбу емкостью 100 мл влить все реактивы и довести объем до метки). По калибровочному графику определить содержание молибдена, соответствующее замеренной оптической плотности раствора. Калибровочный график (зависимость оптической плотности от количества молибдена в мг в мерной колбе емкостью 100 мл) предварительно строят, вводя в мерную колбу емкостью 100 мл от 0,5 до 5 мл стандартного раствора, содержащего 0,1 мг/мл молибдена, и добавляя те же реактивы. Рассчитать содержание молибдена во всем объеме рафината. Расчет результатов По разности между содержанием молибдена в исходном растворе и в рафинате определить количество молибдена в органической фазе и извлечение молибдена. Рассчитать равновесные концентрации молибдена в органической и водной фазах и коэффициент распределения. Построить график зависимости коэффициента распределения от рН (равновесного) и объяснить характер зависимости. В ходе опыта и при расчете результатов данные заносить в таблицу, форма которой приведена ниже. Таблица Форма записи результатов
Порядок допуска к лабораторной работе и требования к отчету Допуск к выполнению работы осуществляется по результатам программированного безмашинного контроля знаний теоретического материала раздела курса «Основы экстракционных процессов». Отчет о работе должен включать краткое изложение содержания работы, протокольные данные опытов и результаты их обработки с объяснением полученных зависимостей.
Литература 1. Погорелый А.Д. Теория металлургических процессов. – М., 1971, с. 417-476. 2. Зеликман А.Н., Беляевская Л.В., Вольдман Г.М. Теория гидрометал-лургических процессов. – М.: Металлургия, 1975. с. 285-341. ЛАБОРАТОРНАЯ РАБОТА №8

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
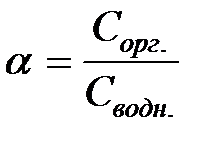
 + n HRо
+ n HRо 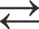 МеRо +
МеRо + 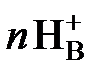
 ди-2-этил-гексилфосфорной кислоты:
ди-2-этил-гексилфосфорной кислоты:

 присоединяются дополнительно две нейтральные молекулы ди-2-этилгексилфосфорной кислоты).
присоединяются дополнительно две нейтральные молекулы ди-2-этилгексилфосфорной кислоты). , где х = 1+4; А – анион кислоты.
, где х = 1+4; А – анион кислоты.
 ,
, и гидрооксония
и гидрооксония  . Поэтому возможно образование (благодаря водородным связям) трибутилфосфатом комплексного катиона не только с протоном, но и с оксонием и гидрооксонием. В последнем случае, как правило, комплексный катион содержит 3 молекулы экстрагента, например:
. Поэтому возможно образование (благодаря водородным связям) трибутилфосфатом комплексного катиона не только с протоном, но и с оксонием и гидрооксонием. В последнем случае, как правило, комплексный катион содержит 3 молекулы экстрагента, например: