
|
|
Способы смещения равновесияПоложение равновесия всегда зависит от внешних условий, а так как внешние условия не могут сохраняться неизменными, то равновесие рано или поздно нарушается (смещается). Влияние изменения внешних условий на положение равновесия - принцип смещения равновесия, или принцип Ле – Шателье: если на систему, находящуюся в устойчивом равновесии, оказать внешнее воздействие, то система отреагирует на это воздействие так чтобы уменьшить его. Влияние давления. Характер влияния давления на равновесие химических реакций определяется знаком разности числа молей газообразных участников реакции Для газовых реакций, в которых число молей продуктов превышает число молей реагентов, т. е. Влияние инертного газа. Введение инертного газа в систему при р =const подобно эффекту уменьшения общего давления. Если реакция протекает с уменьшением числа молей Влияние концентрации. В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево. Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья. Во многих случаях смещение равновесия процесса вправо можно осуществить и выводом продуктов из реакционной зоны — уменьшением концентрации продукта. Влияние температуры. Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т. е усиливает эндотермическое направление процесса. Понижение температуры действует в противоположную сторону, т. е. усиливает экзотермическое направление. Следует отметить, что при изменении температуры равновесие смещается тем сильнее, чем большим тепловым эффектом сопровождается та или иная химическая реакция. Итак, применяя принцип Ле Шателье, можно, не производя термодинамических расчетов, предсказать направление химических реакций, т. е. качественно судить о состоянии их равновесия. 5. Термодинамический анализ. Основные положения эксергетического метода. Равновесие химических реакций Под воздействием подвода или отвода энергии в форме теплоты или работы происходит изменение состояния термодинамической системы (значений термодинамических параметров), называемое термодинамическим процессом. Процессы, представляющие собой непрерывный ряд равновесных состояний, называют равновесным и. При этом равновесным считают состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты. Устойчивое равновесие характеризуется следующими общими условиями: 1) неизменностью равновесного состояния системы во времени при постоянных внешних условиях. 2) подвижностью равновесия (самопроизвольным восстановлением состояния равновесия после снятия внешнего воздействия, вызвавшего отклонение системы от положения равновесия); 3) динамическим характером равновесия, т. е. установлением и сохранением равновесия вследствие равенства скоростей прямого и обратного процессов; 4) возможностью подхода к. состоянию равновесия с двух противоположных сторон; 5) минимальным значением энергии Гиббса (7 в изобарно-изотермических и энергии Гельмгольца F а изо-хорно-изотермических процессах (dG= 0. d2G > 0; df= 0, d2F > 0). Из этих общих условий выводятся конкретные условия для химического равновесия. Химические реакции, как правило, обратимы: наряду с химическим взаимодействием между исходными веществами (прямая реакция) протекает взаимодействие и между продуктами (обратная реакция). По мере протекания процесса скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается; в какой-то момент времени скорости прямой и обратной реакций становятся равными — наступает состояние химического равновесия. Химическое равновесие характеризуется неизменностью числа молекул веществ, составляющих химическую систему, при неизменных внешних условиях. Так как условием равновесия при постоянных Тир служит минимум энергии Гиббса (dG 0), то в условиях химического равновесия должно также соблюдаться равенство (2.1) где - химический потенциал компонента : — количество компонента (моль). Известно, что химическим потенциалом называется величина (2.2) Большая положительная величина ц указывает на высокую реакционную способность частиц. Закон действующих масс*. Впервые зависимость направления химического процесса от концентрации реагирующих веществ установил Н. Н. Бекетов (1865), убедительно обосновав это положение значительным числом опытов. В математической форме закон действующих масс был выражен Гульдбергом и Вааге (1867). Рассмотрим кинетический вывод закона действующих масс на примере гомогенной реакции (I) Как известно из курса общей химии, скорость прямой реакции пропорциональна произведению концентраций реагентов А и В: а скорость обратной реакции — произведению концентраций продуктов R и S: Каждая концентрация возведена в степень, равную стехиометрическо-му коэффициенту компонента в химическом уравнении. Из условия равенства скоростей прямой и обратной реакций в момент химического равновесия (2.3) получаем (2.4) где —равновесные концентрации. Отношение констант скоростей, называемое константой равновесия, обозначим через Кс- Получаем выражение закона действующих масс: (2.5) Как следует из выражения (2.5), константа равновесия не зависит от концентрации, так как изменение концентрации одного из участников реакции вызовет такие изменения концентрации всех остальных веществ, что Кс сохранит свое числовое значение. Таким образом, основное значение закона действующих масс состоит в том, что он устанавливает связь между равновесными концентрациями всех реагирующих веществ. При анализе реакций, протекающих в газовой фазе, константу равновесия выражают через парциальные давления: (2.6) Константа равновесия и энергия Гиббса. Уравнение изотермы Вант-Гоффа. Для рассматриваемой реакции (I) изменение энергии Гиббса выразится уравнением (2.13) Поскольку все участники реакции — идеальные газы, то при постоянной температу е (2.14) где — стандартный химический потенциал вещества J (индекс ° означает стандартное состояние). Для идеальных газов за стандартное принято состояние газа при давлении 0,098 МПа (1 атм) и температуре 298 К. (2.17) Стандартная энергия Гиббса при данной температуре является характерной для реакции постоянной величиной. Поэтому и выражение под знаком логарифма должно быть постоянным. Обозначив его через , получим выражение (2.18) Величина Кг>, входящая в уравнение (2.18), является термодинамической константой равновесия. Не следует забывать, что в выражение термодинамической константы равновесия входят не абсолютные значения равновесных парциальных давлений или концентраций веществ, участвующих в реакции, а относительные, т. е. безразмерные величины (например, давления, отнесенные к значениям стандартного давления). Поэтому термодинамические константы равновесия безразмерны. Уравнение (2.18) называется уравнением изотермы Ван т-Г о ф ф а. Оно в общем виде связывает между собой энергию Гиббса и константу равновесия, которую можно вычислить, зная AG°, Значения стандартных энергий Гиббса образования многих тысяч химических соединений сведены в таблицы термодинамических свойств и приведены в справочной литературе. В случае отсутствия табличных значений их рассчитывают, используя уравнение (2.19) где — стандартные энтальпия и энтропия. Значения этих стандартных термодинамических величин также приводятся в справочной литературе. Порядок и знак величины позволяют качественно предвидеть положение равновесия реакции. Если , равновесие сдвинуто вправо, выход продукта велик, а константа равновесия имеет большое числовое значение. Если , равновесие сдвинуто влево, выход продукта мал, Для протекания реакции слева направо благоприятны большие отрицательные значения (т. е. значительный тепловой эффект) и большие положительные значения (возрастание энтропии). Энт- ропийный член входит в уравнение (2.19) в виде произведения поэтому и повышение температуры усиливает влияние, оказываемое изменением энтропии. В условиях равновесия при любой температуре , т. е. влияние энергетического и энтропийного факторов одинаково. Химическое равновесие в гетерогенных реакциях. В химических гетерогенных системах, как и в гомогенных, условием химического равновесия является соблюдение при постоянных температуре и давлении равенств 2 Способы смещения равновесия Положение равновесия всегда зависит от внешних условий, а так как внешние условия не могут сохраняться неизменными, то равновесие рано или поздно нарушается (смещается). Влияние изменения внешних условий на положение равновесия - принцип смещения равно весия, называемый в литературе принципом ЛеШателье, можно сформулировать следующим образом: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении. Рассмотрим реакцию • где реагенты (А, В) и продукты реакции (R, S) — идеальные газы. При равновесии справедливо равенство (2.23) Если под внешним воздействием изменится значение одного из членов равенства или , то оно нарушится и система выйдет из состояния равновесия. В результате система будет стремиться к достижению нового состояния равновесия, характеризующегося новыми значениями равновесных парциальных давлений реагентов и продуктов. Так как равновесие характеризуется равенством скоростей прямой и обратной реакций, можно сказать, что смещение равновесия происходит в том случае, когда произведенное воздействие неодинакова влияет на скорости прямого и обратного процессов. Это нарушение равенства скоростей и приводит к переходу системы в новое состояние равновесия, при котором скорости прямой и обратной реакций опять станут равными, но будут отличаться от первоначальных значений, Влияние давления. Характер влияния давления на равновесие химических реакций определяется знаком разности числа молей газообразных участников реакции Дл или знаком изменения объема Для газовых реакций, в которых число молей продуктов превышает число молей реагентов, т. е. , увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей ( ), повышение давления целесообразно — оно смещает равновесие реакции в сторону образования продуктов. Чувствительность положения равновесия к изменениям давления тем больше, чем большим изменением объема сопровождается тот или иной процесс. Значительные изменения объема могут происходить только в реакциях, в которых участвуют газы, или в тех случаях, когда хотя бы один из компонентов находится в газообразном состоянии. Количественная оценка влияния давления на состояние равновесия дается уравнением (2.12). Влияние инертного газа. Введение инертного газа в систему при р =const подобно эффекту уменьшения общего давления. Если реакция протекает с уменьшением числа молей , разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов; при увеличении числа молей равновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых , стремятся к уменьшению накопления инертных газов в системе. Так, если в азотно-водо-родно-аммиачной смеси, взятой при , содержалось бы 10% инертного газа, то это равносильно снижению давления на С целью поддержания высоких выходов аммиака в системе регулярно проводятся «продувка» и добавление свежего газа (см. гл. 14). Выводы о влиянии инертного газа непосредственно следуют и из закона Дальтона (2.24) из которого видно, что эффект разбавления (уменьшения N s) подобен эффекту уменьшения общего давления р в системе. Влияние концентрации. В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево. Так, избыток кислорода увеличивает равновесную степень превращения SO2 в SO3. Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья. Во многих случаях смещение равновесия процесса вправо можно осуществить и выводом продуктов из реакционной зоны — уменьшением концентрации продукта. Так, введение в систему водоотнимающих средств (например, H2SO4) позволяет сместить равновесие реакции этерификации вправо: Влияние температуры. Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т. е усиливает эндотермическое направление процесса. Понижение температуры действует в противоположную сторону, т. е. усиливает экзотермическое направление. При изменении температуры процесса равновесие смещается в направлении, для которого изменение энтропии имеет тот же знак, что и изменение температуры. Например, для рассмотренной выше реакции синтеза аммиака , следовательно, повышение температуры усилит реакцию диссоциации аммиака, а понижение температуры будет способствовать протеканию реакции синтеза слева направо. Учет знака теплового эффекта реакции ( ) приводит к тому же выводу: повышение температуры смещает равновесие в сторону исходных реагентов (усиливает эндотермическое направление реакции), понижение температуры действует в противоположном направлении. Следует отметить, что при изменении температуры равновесие смещается тем сильнее, чем большим тепловым эффектом сопровождается та или иная химическая реакция. Итак, применяя принцип Ле Шателье, можно, не производя термодинамических расчетов, предсказать направление химических реакций, т. е. качественно судить о состоянии их равновесия. 6. Скорость гомогенных реакций. Способы изменения скорости простых и сложных реакций. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
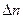 или знаком изменения объема
или знаком изменения объема 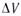
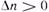 , увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей (
, увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей (  ), повышение давления целесообразно — оно смещает равновесие реакции в сторону образования продуктов.
), повышение давления целесообразно — оно смещает равновесие реакции в сторону образования продуктов.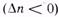 , разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов; при увеличении числа молей
, разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов; при увеличении числа молей 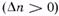 равновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых
равновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых  , стремятся к уменьшению накопления инертных газов в системе.
, стремятся к уменьшению накопления инертных газов в системе.