
|
|
Взаимодействие металлов с кислотами, водойИ растворами щелочей При взаимодействии металлов с агрессивными средами металл выступает в качестве восстановителя. Химическую активность (восстановительную способность) металла характеризует величина электродного потенциала. Стандартным электродным потенциалом называют его электродный потенциал, возникающий при погружении металла в раствор собственной соли с концентрацией Чем меньше значение Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов, получаем ряд стандартных окислительно-восстановительных потенциалов металлов (табл. П.6). В этом ряду все металлы условно делят на активные, средней активности и малоактивные:
Активные металлы Средней активности Малоактивные В роли окислителя в растворах кислот, щелочей и в воде выступает среда (потенциалы в табл. П.8). Реакции возможны, если потенциал окислителя больше потенциала восстановителя. В нейтральной и щелочной среде в роли окислителявыступаетН2О: 2Н2О + 2 ē = Н2 + 2ОН — В растворах разбавленных кислот (HCl, H2SO4) - окислитель Н+: 2Н + + 2 ē = Н2 В присутствии кислорода процесс восстановления протекает с участием кислорода, так как он обладает бóльшими окислительными свойствами, чемН2О и Н+ : O2 + 4 ē + 4Н + = 2Н2О (в кислой среде); О2 + 4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах). В H2SO4 (конц.) и HNO3 (разб.), HNO3 (конц.) окислителем являются анионы кислот. Степень восстановления анионов определяется активностью металла: H2SO4 (конц.) + Me (активные) ® сульфат Ме + H2S + Н2О H2SO4 (конц.) + Me (средней активности) ® сульфат Ме +S + Н2О H2SO4 (конц.) + Me (малоактивные) ® сульфат Ме + SO2+ Н2О HNO3 (разб.) + Me (активные) ® нитрат Ме + NH4NO3 + Н2О HNO3 (разб.) + Me (средней активности) ® нитрат Ме +N2, N2O + Н2О HNO3 (разб.) + Me (малоактивные) ® нитрат Ме + NO + Н2О HNO3 (конц.) + Me (независимо от активности) ® нитрат Ме + NO2 + Н2О Внимание!Три распространенных металла – Al, Cr, Fe – на холоде не растворяются в H2SO4(конц.) и HNO3(конц.). В этих кислотах они пассивируются, т. е. покрываются тонкой прочной пленкой, предохраняющей их от разрушения. Реакции протекают только при повышенной температуре. Задание к подразделу 4.2
Используя потенциалы (табл. П.6, П.7, П.8), допишите уравнения реакций (по две для каждого варианта), составив к ним электронно-ионные схемы. Для реакций металлов с H2SO4 (конц.) и HNO3 значение потенциала окислителя более 1 В. Оцените практическую устойчивость металлов в данной среде.
Гальванические элементы
Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется непосредственно в электрическую. Методика рассмотрения работы гальванических элементов: · Составляют схему гальванического элемента: (–) Me1 / Me1n + // Me2 m+ / Me2 (+) · По уравнению Нернста находят потенциалы электродов. · Указывают движение электронов во внешней цепи: от электрода с меньшим потенциалом к электроду с более высоким потенциалом. · Записывают уравнения электродных процессов, определяют характер этих процессов. · Составляют суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе. · Рассчитывают величину ЭДС гальванического элемента как разность потенциалов положительного и отрицательного электродов. Пример 1. Гальванический элемент с водородным электродом. · Схема Zn / ZnSO4 // H2SO4 , Н2 / Pt.
· Электродные потенциалы
· Направление движения электронов во внутренней цепи - от цинкового электрода к водородному, так как потенциал цинкового электрода меньше. ē
(–) Zn / ZnSO 4 // H2SO4 , Н2 / Pt (+)
SO42 - · Уравнения электродных процессов: Zn (-): Zn - 2 ē = Zn 2+ - процесс окисления; Pt (+): 2Н ++ 2 ē = Н 2 - процесс восстановления. · Суммарное уравнение: Zn + 2Н + = Zn 2+ + Н 2 Zn + H2SO4 = ZnSO4 + Н 2 · Расчет величины ЭДС: ЭДС = Е0Ox - Е0Red = 0 – (- 0,76) = 0,76 В. Пример 2. Концентрационный гальванический элемент Оба электрода из одного металла, но растворы солей, в которые погружены электроды, разной концентрации. · Схема гальванического элемента: Ni / NiSO 4( Стандартный электродный потенциал · Вычисление электродных потенциалов по уравнению Нернста:
· Направление движения электронов по внешней цепи от Ni1 электрода к Ni2, так как ē
(-) Ni1 / NiSO4 (10-4 М) // NiSO4 (1 М) / Ni 2 (+)
SO42– · Уравнения электродных полуреакций: Ni1 (-): Ni - 2 ē = Ni 2+ - процесс окисления; Ni2 (+): Ni2+ + 2 ē = Ni -процесс восстановления. · Расчет величины ЭДС: ЭДС =
Задания к подразделу 4.3
Для предложенных гальванических элементов рассчитайте электродные потенциалы и ЭДС. Если концентрация раствора не указана, потенциал примите стандартным (табл.П.6). Напишите уравнения анодного и катодного процессов, молекулярное уравнение токообразующей реакции, составьте схему и укажите направления движения электронов и ионов.
301.Al / Al2(SO4)3, 0,005 M // NiSO4, 0,01 М / Ni 302.Ni / NiSO4, 0,1 M // H2SO4 / H2 (Pt) 303.Sn / SnSO4 // Cr2(SO4)3, 0,05 M / Cr 304.(Pt) H2 / H2SO4 // Al2(SO4)3, 0,005 M / Al 305.Cu / CuSO4, 0,1 M // H2SO4 / H2 (Pt) 306.Ag / AgNO3, 0,01 M // H2SO4 / H2 (Pt) 307.Co / CoSO4, 0,01 M // CoSO4 / Co 308.Zn / ZnSO4, 0,1 M // FeSO4, 0,01 M / Fe 309.Ag / AgNO3, 0,01 M // Zn(NO3)2 / Zn 310.(Pt) H2 / H2SO4 // ZnSO4, 0,01 M / Zn 311.Cd / Cd(NO3)2, 0,1 M // Cd(NO3)2, 0,001 M / Cd 312.Ni / NiSO4, 0,001 M // NiSO4 / Ni 313.Fe / FeCl2 // FeCl2, 0,01 M / Fe 314.Cr / Cr2(SO4)3, 0,005 M // ZnSO4 / Zn 315.Zn / Zn(NO3)2, 0,001 M // Zn(NO3)2 / Zn 316.Ag / AgNO3 // Cr(NO3)3, 0,005 M / Cr 317.Cd / CdCl2, 0,1 M // CuCl2, 0,1 M / Cu 318.Ti / Ti2(SO4)3, 0,5 M // CuSO4 / Cu 319.Sn / SnSO4, 0,01 M // Fe2(SO4)3 / Fe 320.Ag / AgNO3, 0,0001 M // Pb(NO3)2 , 0,1 M / Pb

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 =1 моль/л, измеренный по отношению к стандартному водородному электроду, потенциал которого при 25 0С условно принимается равным нулю.
=1 моль/л, измеренный по отношению к стандартному водородному электроду, потенциал которого при 25 0С условно принимается равным нулю. , тем большими восстановительными свойствами обладает данный металл.
, тем большими восстановительными свойствами обладает данный металл.

 б) Sn + NaOH + O2 + H2O
б) Sn + NaOH + O2 + H2O
 1 моль/л,
1 моль/л,  1 моль/л, Т = 298 К, P = 101,3 кПa .
1 моль/л, Т = 298 К, P = 101,3 кПa . = 0 В ,
= 0 В ,  = - 0,76 В (при
= - 0,76 В (при  1 моль/л).
1 моль/л).



 = 10-4 моль/л)// NiSO 4 (
= 10-4 моль/л)// NiSO 4 (  =1моль/л) / Ni
=1моль/л) / Ni = - 0,25 В.
= - 0,25 В. =
=  +
+  · lg
· lg  = -0,25 +
= -0,25 +  ·lg 10 -4 = -0,309 B.
·lg 10 -4 = -0,309 B. =
=  = - 0,25 B.
= - 0,25 B. >
> 



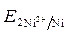 -
-  = - 0,25 - (- 0,309) = 0,059 В.
= - 0,25 - (- 0,309) = 0,059 В.