
|
|
Методы выделения и очистки ферментов.Более тонкую очистку веществ осуществляют несколькими способами. Хроматография. Каплю образца наносят на специальную бумагу (хроматография на бумаге) или пластинку стекла или пластмассы, покрытую тонким слоем инертного сорбента, например, целлюлозы или силикагеля (хроматография в тонком слое или тонкослойная хроматография). Затем такую пластинку одним концом помещают в смесь растворителей (например, воды и спирта). По мере движения растворителей по пластинке, они подхватывают те молекулы образца, которые растворяются в них. Растворители выбирают так, чтобы они связывались сорбентом по-разному. В результате молекулы образца, более растворимые в связанном растворителе, движутся медленнее, а другие, более растворимые в слабо сорбированном растворителе, движутся быстрее. Через несколько часов пластинку сушат, окрашивают и определяют положение различных молекул. Хроматография на колонках (колоночная). Смесь молекул в растворе пропускают через колонку, содержащую твердый пористый матрикс. В результате взаимодействия с матриксом различные молекулы проходят через колонку с различной скоростью. После того как они достигнут в определенной последовательности дна колонки, их собирают отдельными фракциями, разработано и применяется множество матриксов различных типов, используя которые можно делить белки согласно их: 1)заряду (ионообменная хроматография), 2)гидрофобности (гидрофобная хроматография), 3)размеру (хроматография гель-фильтрацией) 4)способности связываться различными химическими группами (аффинная хроматография). Гораздо более эффективен метод аффинной хроматографии (хроматография по сродству). В основе этого метода лежат биологически важные взаимодействия, происходящие на поверхности белковых молекул. При аффинной хр-ии используется нерастворимый матрикс, ковалентно связанный со специфичными лигандами (антителами или субстратом ферментов), которые присоединяют определенный белок. Однократная хроматография на такой колонке позволяет зачастую достигнуть очень высокой степени очистки препарата. Разработанные недавно хроматографические смолы (в основу которых обычно положен кремний) имеют форму мельчайших сфер от 3 до 10 мкм в диаметре, которые упакованы в специальный чехол и образуют гомогенную колонку. Такие колонки для высокоэффективной жидкостной хроматографии (ВЖХ) обеспечивают высокий уровень разрешения. Т.к. частицы носителя в колонках для ВЖХ упакованы оч. плотно, в отсутствие высокого давления скорость потока через них незначительна. Т. о., ранее для достижения плохого разделения с помощью колоночной хроматографии требовались часы, а в настоящее время благодаря ВЖХ качественное фракционирование занимает минуты. Экстракты разрушенных клеток можно фракционировать, подвергая их высокоскоростному центрифугированию. Такая обработка делит клеточные компоненты по их размеру: более крупные частицы при центрифугировании движутся быстрее. Крупные компоненты экстракта, в том числе ядра или неразрушенные клетки, быстро оседают (седиментируют) при относительно низких скоростях и образуют осадок на дне центрифужной пробирки. Центрифугирование является, как правило, первым этапом фракционирования, с его помощью разделяются только значительно отличающиеся по размеру компоненты. Чтобы достигнуть более высокой степени разделения фракций, необходимо гомогенат наслоить тонким слоем поверх солевого раствора. При ультрацентрифугировании различные фракции седиментируют с различной скоростью и образуют отдельные полосы, которые можно выделить. Ультрацентрифуга разделяет клеточные компоненты не только по массе, но и по плавучей плотности. В этом случае образец седиментирует в крутом градиенте, образованном высококонцентрированным раствором сахарозы или хлористого цезия. Компоненты клеток опускаются по градиенту до тех пор, пока не достигнут участка, плотность раствора в котором равна собственной плотности компонентов. Дальнейшей седиментации компонентов не происходит и они «застревают» на этом уровне. Таким образом в центрифужной пробирке возникает набор различных полос. Электрофорез– метод разделения белков и нуклеиновых кислот в свободном водном растворе и пористом матриксе, в качестве которого можно использовать полисахариды, например, крахмал или агарозу. Биомолекулы обычно несут суммарный положительный или отрицательный заряд, обусловленный наличием на их поверхности положительно или отрицательно заряженных групп аминокислот. Если белковые молекулы поместить в электрическое поле, они начинают перемещаться со скоростью, которая определяется их суммарным зарядом, а также формой и размерами. В середине 60-х годов был разработан модифицированный метод электрофореза - электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ). При использовании данного метода белки мигрируют в инертном матриксе-полиакриламидном геле с высоким содержанием поперечных сшивок. Обычно гель готовят полимеризацией мономеров непосредственно перед использованием. Размеры пор геля могут быть подобраны произвольно с тем, чтобы гель мог замедлить миграцию определенных молекул. Смесь молекул делится на ряд полос, расположенных в соответствии с их молекулярной массой. Выявить эти полосы можно путем окрашивания соответствующим красителем. Так происходит разделение белков в одном направлении двумерного гель-электрофореза. На втором этапе гель, содержащий разделенные белки, снова подвергается электрофорезу, на этот раз в направлении перпендикулярном тому, что на первом этапе. В этом случае электрофорез ведут в присутствии ДСН и белки разделяют по их молекулярной массе, как в одномерном ДСН-ПААГ. Исходный гель пропитывают додецил-сульфатом натрия и, поместив его на блок ДСН-ПААГ-геля, проводят электрофорез, где каждая из ППЦ мигрирует сквозь блок геля и образует в нем отдельную полосу. Неразделенными в результате остаются только те бели, которые неразличимы как по изоэлектрической точке, так и по молекулярной массе; такое сочетание встречается очень редко.
34. Биокатализ. - ускорение с помощью ферментов химических реакций, протекающих в живых организмах. Это процесс высокоэффективный, специфичный и, в отличие от хим. катализа, происходит в «мягких», т. е. свойственных живому организму, условиях (t, давление, реакция среды и т.д.). В последние годы в связи с интенсивным развитием биотехнологии и промышленной микробиологии наметились 2 основные тенденции использования биокатализа для нужд хим. промышленности. значительно возрос интерес к альтернативным процессамполучения хим. соединений. Пристальное внимание уделяется разработкегибридных процессов, в которых одной из ключевых стадий является БХ-конверсия субстрата, модернизации традиционных химических производств, введением в производственный процесс биокаталитической стадии с участием ферментов или бактериальных клеток. Альтернативные процессы. Одно ведущих мест в промышленном освоении биокаталитических процессов занимают процессы окислительной биотрансформации орг-х соединений, в т.ч., углеводородного сырья, (Япония, Америка, Западная Европа). Процессы селективного окисления легких газообразных углеводородов в ценные окси-продукты являются ключевыми для хим. производств переработки газа и нефти. Использование биокатализа и биотехнологии для производства химикатов - нетрадиционный подход к решению проблем основного органического синтеза. Биокаталитические процессы привлекают внимание своими уникальными характеристиками: малой энергоемкостью вследствие мягких условий протекания реакций (температуры не выше 40оС); высокой селективностью, близкой к 100%, которая, что очень важно, не зависит от степени превращения исходного субстрата; а также стереоспецифичностью, заключающейся в образовании хиральных соединений. Минус биотехнологичеких процессов является низкая концентрация в реакционной среде конечного продукта, не превышающая десятков мМ, данные проблемы решаются путем оптимизации процесса в целом, 1 стадия разработки биотехнологического процесса заключается в поиске (скрининге) мО, обладающих необходимой биокаталитической активностью. Следующая стадия, на которой в присутствии аммиака, образуется L-аспарагиновая кислота, является биокаталитической, и осуществляется ферментом аспартазой, который катализирует присоединение аммиака по двойной связи фумаровой кислоты. Поскольку аспартаза является внутриклеточным ферментом, то требуется сложная и многостадийная процедура ее выделения из бактериальных клеток.
35. Биосенсоры.Биосенсорная технология сочетает в себе достижения биологии и современной микроэлектроники. Биосенсор обычно состоит из биологического компонента (клетки, фермента или антитела), соединенного с крошечным преобразователем – прибором, приводимым в действие одной системой и передающим энергию (обычно в другой форме) другой системе. Биосенсоры являются детекторами, действие которых основано на специфичности клеток и молекул и используется для идентификации и измерения количества малейших концентраций различных веществ. При связывании искомого вещества с биологическим компонентом биосенсора преобразователь генерирует электрический или оптический сигнал, мощность которого пропорциональна концентрации вещества. Биосенсоры могут быть использованы для: измерения пищевой ценности, свежести и безопасности продуктов питания; экспресс-анализа крови непосредственно у кровати больного; обнаружения и измерения степени загрязнения окружающей среды; детекции и определения количества взрывчатых веществ, токсинов и возможного биологического оружия. Начаты разработки новых поколений биодатчиков на фазе аффинных взаимодействий (биосродства) типа фермент – ингибитор, АТ-АГ, антагонист – клеточный рецептор, а также на основе полупроводниковых структур и мезоэлектрического эффекта. Последние два биодатчика дают возможность создавать сенсоры, чувствительные к глазам, что имеет существенное значение для создания роботов, реагирующих на изменения внешних воздействий. Технологические варианты реакторов с иммобилизованными ферментами весьма разнообразны – колонки, трубки, полые волокна. С их помощью на практике определяют концентрацию широкого спектра соединений – глюкозы, аминокислот, мочевины, желчных кислот, АТФ, НАДН, ФМН, стероидов. Американскими исследователями сконструирован микродатчик на основе глюкозооксидазы и рутениевого красителя, иммобилизованных в полиакриламидной матрице с использованием субмикронных оптических волокон. Микробиосенсор, не вызывая повреждений, может быть введен в клетку и даже в отдельные ее компартменты для измерения содержания в них глюкозы и кислорода. Предложены датчики на базе иммунодетекции для проведения экспресс-анализов на присутствие производных диоксина и оценки содержания биогенных аминов в пищевых продуктах в связи с процессами их старения. Для определения мочевины ферментным электродом требуется всего 30 сек. Биосенсоры на основе иммобилизованных ферментов помогают выполнять десятки быстрых и точных анализов при диагностике заболеваний, контролировать содержание вредных веществ в пищевых продуктах и в воздухе. Биосенсоры нашли применение в решении аналитических задач в химической и микробиологической промышленности, а также в научных исследованиях.
36. Биодеградация и биодетоксикация ксенобиотиков. Ксенобиотики – чужеродные для организмов соединения (пестициды, ПАВ, красители, лекарственные вещества и пр.), которые практически не включаются в элементные циклы углерода, азота, серы или фосфора. Ксенобиотики временно или постоянно накапливаются в окружающей среде и вредно влияют на живое. Широкое и повсеместное применение пестицидов, в том числе не разлагаемых, накопление различных отходов в огромных количествах привело к широкому распространению загрязнения окружающей среды. Накопление ксенобиотиков представляет огромную опасность для человека, употребляющего в пищу крупную рыбу и высших животных. Судьба химических соединений, попадающих в окр. среду, определяется комплексом физ., хим. и биол. факторов. Деградация ксенобиотиков м. происходить в результате физ. и хим. пр-сов и зависит от типа почвы, ее структуры, влажности, t и пр. Биол. трансформация соединений, попавших в окр. среду, м. протекать в различных направлениях, приводя к минерализации, накоплению или полимеризации. Ксенобиотики, которые подвергаются полной деградации, т.е. минерализуются до диоксида углерода, воды, аммиака, сульфатов и фосфатов, исп-ся мО в качестве основных ростовых субстратов и проходят полный метаболический цикл. Частичная трансформация соединений происходит в процессах кометаболизма или соокисления и не связана с включением образуемых продуктов в метаболический цикл мО. некоторые ароматические углеводороды и синтетические полимеры вообще не поддаются биол. трансформации. Поведение ксенобиотика в природе зависит от многих взаимосвязанных факторов: структуры и свойств самого соединения, физ-хим. условий среды и ее биокаталитического потенциала. Все эти факторы в совокупности определяют скорость и глубину трансформации ксенобиотика. Биологическая деградация ксенобиотиков оправдана только тогда, когда происходит их полная минерализация, разрушение и детоксикация. Это м.б. достигнуто в результате всего одной модификации структуры соединения. Важную роль в удалении ксенобиотиков из окр. среды играют разнообразные типы микробного метаболизма. В природных условиях на ксенобиотики воздействую микробные сообщества. В них проявляются различные типы взаимодействия: кооперация, комменсализм, взаимопомощь. Есть 2 пути для борьбы с загрязнением биосферы ксенобиотиками: сбор и детоксикация ксенобиотиков до момента попадания в окр. среду и трансформация или удаление ксенобиотиков, попавших в среду. Возможности микробных сообществ в отношении деградации многих токсичных соединений значительны. После попадания ксенобиотиков в окр. среду из почвы можно выделить микробные виды, способные деградировать конкретные ксенобиотики и далее среди них вести селекцию на увеличение скорости деградации. При попадании новых веществ в окр. среду может происходить природное генетическое конструирование, в рез-те кот. возникают микробные формы с новыми катаболическими функциями. Б-во пестицидов, попадающих в окр. среду в рез-те использования их для обработки с/х культур, расщепляются бактериями и грибами. Высокая токсичность ряда пестицидов м. утрачиваться уже на первой стадии микробной трасформации. На основе иммобилизованных ферментов возможно удаление пестицидов из сточных вод; ферменты применяют в виде аэрозолей для удаления пестицидов с промышленных установок. Особую проблему представляют выбросы и аварийные разливы нефти на поверхность почвы. Это приводит к загрязнению пахотных земель и источников питьевой воды. В почве содержится много микробных видов, способных деградировать углеводороды, но их активность часто низка, в том числе и в результате дефицита отдельных биогенных элементов. Эффективным является внесение в почву так называемых «олеофильных удобрений», в состав которых входят соединения азота, фосфаты и другие минеральные элементы, концентрации которых в почве достаточно низки и лимитируют рост микроорганизмов. После внесения этих соединений в почву концентрация микроорганизмов-деструкторов существенно возрастает, и возрастает скорость деградации нефти. С помощью ген. конструирования создан «супермикроб», способный утилизировать б-во углеводородов нефти. Многие штаммы Pseudomonas putida несут плазмиды, кот. кодирует фермент для расщепления одного класса углеводородов – плазмида OCT обуславливает расщепление октана, гексана, декана; XYL – ксилола и толуола; CAM – камфары, NAH – нафталина.
37. Методы иммобилизации ферментов и клеток. Иммобилизованные клетки имеют ряд преимуществ как перед иммобилизованными ферментами, так и перед свободными клетками: 1)отсутствие затрат на выделение и очистку ферментов; 2)снижение затрат на выделение и очистку продуктов реакции;3)более высокая активность и стабильность;4)возможность создания непрерывных и полунепрерывных автоматизированных процессов; 5)способность к длительному функционированию полиферментных систем без экзогенных кофакторов. Для иммобилизации могут быть использованы клетки в различном состоянии: живые и поврежденные в различной степени. Одностадийные реакции могут осуществлять и живые, и поврежденные клетки. Полиферментные реакции проводят с применением живых клеток, которые могут длительное время регенерировать АТФ и коферменты (НАДФ, НАД). Методы иммобилизации клеток схожи с методами иммобилизации ферментов. Хим. метод основан на образовании ковалентных связей с активированным носителем, на поперечной сшивке клеток за счет активных групп в клеточной оболочке с бифункциональными реагентами ( глутаровым альдегидом). К физ. методам относятся адсорбция и агрегация. Иммобилизация клеток путем включения в различные гели, мембраны, волокна основана на химических и физических взаимодействиях. Химические методы используются реже по сравнению с другими методами и малопригодны для иммобилизации живых клеток. Большее распространение получило включение клеток в состав гелей, мембран и волокон. так клетки могут сохранять жизнеспособность и в присутствии питательной среды размножаться в приповерхностных слоях гелей. Биокаталитическая активность целых иммобилизованных клеток в настоящее время может быть использована в различных отраслях науки и техники: 1)при биосинтезе и трансформации таких соединений, как аминокислоты, органические кислоты, антибиотики, стероиды углеводы, углеводороды, нуклеотиды и нуклеозиды; 2)в пивоварении и виноделии; 3)при очистке сточных и природных вод; 4) при извлечении металлов из сточных вод;5)при ассимиляции солнечной энергии; 6)при изготовлении водородных солнечных элементов; 7)в азотфиксации; 8)в аналитических целях при изготовлении электродов. Ферменты и ферментные системы широко используются в различных отраслях промышленности, медицине, с/х, хим. анализе и т.д. Ферменты - вещества белковой природы и поэтому неустойчивы при хранении и чувствительны к тепловым воздействиям. Они не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому методу было положено в 1916 году, когда Дж.Нельсон и Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в таком виде каталитическую активность. Сам термин "иммобилизованные ферменты узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве. Сущность иммобилизации ферментов — прикрепление их в активной форме к нерастворимой основе или заключение в полупроницаемую мембранную систему. Прикрепление фермента к носителю осуществляется адсорбционно-химической связью или путем механического включения фермента в органический или неорганический гель (в капсулу и т. п.). Носитель фермента может быть как природное вещество, так и синтетический полимер. Плюсы иммобил-х ферментов перед нативными предшественниками: 1) Гетерогенный катализатор легко отделим от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт. 2) Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость катализируемой реакции и выход продукта. 3) Модификация фермента целенаправленно изменяет его свойства, такие как специфичность (особенно в отношении макромолекулярного субстрата), зависимость каталитической активности от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям. 4) Можно регулировать каталитическую активность иммобилизованных ферментов путем изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путем связывания на нерастворимых носителях, так и путем внутримолекулярной или межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путем присоединения к растворимому полимеру.
Два вида систем культивирования: открытую и закрытую. Для закрытой системы характерен периодический режим выращивания. Клеточная масса (инокулят) помещается в определенный объем среды. Система закрыта по всем параметрам, кроме газов, до конца выращивания. Периодически подается свежая питательная среда, а старая удаляется в том же объеме. Клетки остаются в системе в течение всего цикла выращивания. Открытые (проточные) культуры характеризуются поступлением свежей питательной среды, при котором отбирается не только старая питательная среда, но и часть урожая клеточной массы. Наиболее изучено и распространено закрытое глубинное культивирование. Периодическое, или накопительное, культивирование — это самый простой способ выращивания клеток, являющийся пока традиционным. Суспензионные культуры используют для промышленного получения вторичных метаболитов. Вещества, продуцируемые растительными клетками используются в медицине, парфюмерной промышленности, растениеводстве и других отраслях промышленности. К ним относятся: алкалоиды, терпеноиды, гликозиды, полифенолы, полисахариды, эфирные масла, пигменты, антиканцерогены (птотецин, харрингтонин), пептиды (ингибиторы фитовирусов). Получение вторичных метаболитов имеет свои особенности. Деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Накопление вторичных метаболитов возрастает в фазе замедленного роста клеточной популяции и достигает максимума в стационарной фазе. Необходимо учитывать, что вопрос взаимодействия первичного и вторичного метаболизма, рассмотренный нами в упрощенном виде, намного сложнее.
40. Классификация ферментов. По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации. Классификация была предложена Международным союзом биохимии и молекулярной биологии. Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом: КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа. КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза. КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза. Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
42. Биотехнологии в пищевой промышленности. Пища должна быть разнообразной и содержать БЖУ и витамины. Источники энергии — ЖУ в определенных пределах взаимозаменяемы, причем их можно заменить и белками, но белки нельзя заменить ничем. Проблема питания людей в конечном счете заключается в дефиците белка. Там, где сегодня люди голодают, не хватает прежде всего белка. Наибольшую популярность как источники белка приобрели семена масличных культур — сои, семян подсолнечника, арахиса и других, которые содержат до 30 процентов высококачественного белка. По содержанию некоторых незаменимых амин. к-т он приближается к белку рыбы и куриных яиц и перекрывает белок пшеницы. Эффективным источником белка могут служить водоросли. Увеличить количество пищевого белка можно и за счет микробиол-го синтеза, который в последние годы привлекает к себе особое внимание. Микроорг-ы чрезвычайно богаты белком — он составляет 70—80 процентов их веса. Скорость его синтеза огромна. Микроорг-ы примерно в 10—100 тысяч раз быстрее синтезируют белок, чем животные. Да к тому же технологический процесс куда менее трудоемок, чем с/х пр-во, не говоря уже об исключении сезонных влияний погоды — заморозков, дождей, суховеев, засух, освещенности, солнечной радиации и т. д. Из 20 аминокислот, входящих в состав белков, 8 аминокислот люди не могут синтезировать, и их относят к незаменимым. Это изолейцин, лейцин, лизин, метионин, треонин, триптофан, валин, фенилаланин. Амин.к-ты — это не только питательные вещества, но также ароматические и вкусовые агенты, и потому они широко используются в пищевой пром-ти. Как питательную добавку в пищу чаще всего вносят лизин и метионин. Глутамат натрия и глицин употребляют как ароматические вещества для усиления и улучшения вкуса пищи. У глицина освежающий, сладкий вкус. Его вводят в сладкие напитки, и кроме того, он проявляет там бактериостатическое действие. Аминокислоты в большом количестве применяют как добавку к растительным кормам, которые дефицитны по метионину, треонину, триптофану и особенно по лизину. Микробиологический синтез,синтез структурных элементов или продуктов обмена веществ микроорганизмов за счёт присущих микробной клетке ферментных систем. При М. с., как и любом органическом синтезе, сложные вещества образуются из более простых соединений. М. с. следует отличать от брожения, в результате которого тоже получаются различные продукты микробного обмена (например, спирты, органические кислоты), но преимущественно за счёт распада органического вещества. Значительная часть продуктов, образующихся в ходе М. с., обладает физиологической активностью и представляет практическую ценность для народного хозяйства. Для производства разнообразных продуктов М. с. в РФ создана микробиологическая промышленность, уже выпускающая большой ассортимент соединений разных классов. Работы в области М. с. проводятся почти во всех промышленно развитых странах. Во многих из них продукты М. с. являются важной составляющей экономики страны, например производство ферментов и аминокислот — в Японии, лекарственных препаратов — в Венгрии.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
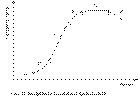 38. Стадии роста при периодическом культивировании. Кривая роста. Ростовые кривые имеют S-образную форму и состоят из нескольких участков: 1- латентная, или лаг-фаза, где видимый рост не наблюдается ни по одному из критериев; 2 - экспоненциальная, рост с ускорением; 3 - линейная, где скорость роста постоянна; 4 - фаза замедленного роста; 5 - стационарная фаза; 6 - фаза деградации клеток (рис.). Реальная ростовая кривая может несколько отличаться от модельной. На форму ростовых кривых влияют и генетическая характеристика популяции (вид растения), и количество инокулята, и условия выращивания (состав среды, начальное значение рН, состав газовой фазы, скорость перемешивания). Ростовые кривые для разных критериев не идентичны. Дисбаланс между скоростями клеточного размножения (число клеток), синтеза структурных элементов клетки (сухая масса) и увеличения объема и содержания вакуолей (сырая масса) отражает специфику онтогенеза высшего растения.
38. Стадии роста при периодическом культивировании. Кривая роста. Ростовые кривые имеют S-образную форму и состоят из нескольких участков: 1- латентная, или лаг-фаза, где видимый рост не наблюдается ни по одному из критериев; 2 - экспоненциальная, рост с ускорением; 3 - линейная, где скорость роста постоянна; 4 - фаза замедленного роста; 5 - стационарная фаза; 6 - фаза деградации клеток (рис.). Реальная ростовая кривая может несколько отличаться от модельной. На форму ростовых кривых влияют и генетическая характеристика популяции (вид растения), и количество инокулята, и условия выращивания (состав среды, начальное значение рН, состав газовой фазы, скорость перемешивания). Ростовые кривые для разных критериев не идентичны. Дисбаланс между скоростями клеточного размножения (число клеток), синтеза структурных элементов клетки (сухая масса) и увеличения объема и содержания вакуолей (сырая масса) отражает специфику онтогенеза высшего растения.